微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (17分)铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是 (只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计成铁铜原电池,请图甲中的横线上完成标注。
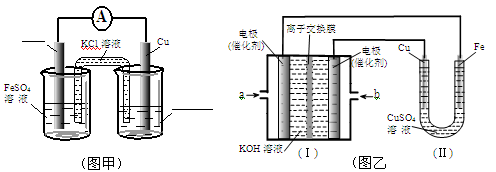
②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入 (填“CH4”或“O2”),b处电极上发生的电极反应式为 ==4OH-;
若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,当阳极产生的气体为448mL(标准状况下)时,溶液的pH= (假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后,直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
参考答案:(1)Cu2++2H2O Cu(OH)2+2H+
Cu(OH)2+2H+
(2)①(见图)
②CH4 O2+4e-+2H2O 13
(3)存在溶解平衡:FeS(s) Fe 2+(aq)+ S 2-(aq),其中的Cu2+与S 2-生成了溶度积更小的CuS沉淀,使得上述溶解平衡继续向右移动。[或用平衡FeS(s)+Cu2+(aq)=" CuS(s)+" Fe 2+(aq)解释]
Fe 2+(aq)+ S 2-(aq),其中的Cu2+与S 2-生成了溶度积更小的CuS沉淀,使得上述溶解平衡继续向右移动。[或用平衡FeS(s)+Cu2+(aq)=" CuS(s)+" Fe 2+(aq)解释]
本题解析:(1)加入稀硫酸是为了抑制Cu2+的水解;(2)图乙在Fe上镀铜,所以Fe作阴极,则连接的为燃料电池的负极,应通入CH4,b极通入O2发生还原反应:O2+4e-+2H2O =4OH-;电解池中均为惰性电极时,阳极的电极反应式为:2Cl--2e-=Cl2↑ ,阴极反应式为:2H++2e-=H2 ↑ .由电极反应式计算消耗的H+为0.04mol,则生成的OH-为0.04mol,c(OH-)=0.1mol/L,则c(H+)=10-13mol/L,pH=13;(3)应用了难溶电解质的沉淀溶解平衡,溶液中存在溶解平衡:FeS(s)  Fe 2+(aq)+ S 2-(aq),Cu2+与S 2-反应可生成溶度积更小的CuS沉淀,使得上述溶解平衡继续向右移动。
Fe 2+(aq)+ S 2-(aq),Cu2+与S 2-反应可生成溶度积更小的CuS沉淀,使得上述溶解平衡继续向右移动。
考点:盐类水解、原电池原理及计算、难溶电解质的沉淀溶解平衡。
本题难度:困难
2、实验题 (共11分) 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
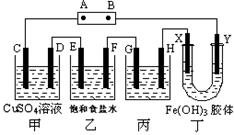
(1)电源A 极的名称是___________
(2)乙装置中电解反应的总化学方程式是________________
(3)如果收集甲、乙装置中C、D、E、F产生的物质的物质的量之比是________
(4)欲用丙装置给铜镀银,G应该是_____(填名称),电镀液的主要成分是______(填化学式)
(5)装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带_________电荷。
(6)从Cu2+、Na+、SO42-、Cl-四种离子中恰当地组成电解质,按下列要求进行电解,
写出所有符合要求的物质化学式。
①、以石墨为电极进行电解,使电解质质量减少,水质量不变,采用的电解质是________
②、以石墨为电极进行电解,使电解质质量不变,水质量减少,采用的电解质是________
③、以碳棒为阳极,铁棒为阴极进行电解,使电解质和水的质量都减少,采用的电解质是___
参考答案:(1)正极 (1分)(2)2NaCl+2H2O  2NaOH+H2 ↑+Cl2↑(2分)
2NaOH+H2 ↑+Cl2↑(2分)
(3)1:2:2:2 (2分)(4)银? AgNO3 (2分)(5) 正(1分)
(6)①CuCl2?②Na2SO4?③NaCl、CuSO4(3分,少一个0分)
本题解析:考查电化学的应用。
(1)向乙中滴入酚酞试液,在F极附近显红色,说明F电极是阴极,则E是阳极、D是阴极、C是阳极,所以A是正极,B是负极,Y是阴极,X是阳极,H是阴极,G是阳极。
(2)电极饱和食盐水的生成物是氯气、氢气和氢氧化钠,反应式为2NaCl+2H2O  2NaOH+H2 ↑+Cl2↑。
2NaOH+H2 ↑+Cl2↑。
(3)甲中C电极产生氧气,D产生铜,E生成氯气,F生成氢气。根据电子得失守恒可知产生的物质的物质的量之比是1:2:2:2。
(4)电镀是镀层金属作阳极,待镀金属作阴极,用含有镀层金属离子的溶液作电解质溶液。G是阳极,所以G应该是银,电镀液 的主要成分是硝酸银。
(5)Y电极是阴极,而Y极附近红褐色变深,说明氢氧化铁胶体向阴极移动,所以胶粒带正电荷。
(6)①属于电解电解质自身的,所以是氯化铜。②是电解水的,则为硫酸钠。③是既电解电解质自身,还电解水,所以是氯化钠或硫酸铜。
本题难度:一般
3、选择题 电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是(?)
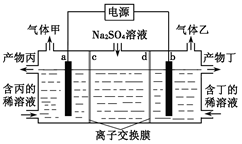
A.a极与电源的负极相连
B.产物丙为硫酸溶液
C.离子交换膜d为阴离子交换膜
D.a电极反应式:2H2O+2e-= H2↑+2OH-
参考答案:B
本题解析:电解硫酸钠溶液,阴极为氢离子放电,产生氢气,阳极为氢氧根离子在放电,产生氧气,因气体甲与气体乙的体积比约为1∶2,故气体甲为氧气,气体乙为氢气,产物丙为硫酸溶液,产物丁为氢氧化钠溶液。故A错误;a极为阳极,与电源的正极相连,A错误;b为阴极,与电源的负极相连;离子交换膜c为阴离子交换膜,允许氢氧根离子通过, 离子交换膜d为阳离子交换膜,允许氢离子通过,C错误;a电极反应式:2H++2e-= H2↑,D错误。
点评:电解池是历年高考常考知识点,注重考查学生分析问题、解决问题的能力。
本题难度:一般
4、选择题 常温下,下列各组数据中比值为2:1的是( )
A.电解熔融的氯化钠,在阴极和阳极上析出产物的物质的量之比
B.中和体积相同、pH相同的硫酸和盐酸消耗NaOH的物质的量之比
C.1mol/L氨水与0.5mol/L氨水中的c(OH-)之比
D.物质的量相同的水和乙醇与足量金属钠反应产生氢气的体积之比
参考答案:A、电解熔融氯化钠阳极生成氯气电极反应2Cl--2e-═Cl2↑,阴极上生成钠,电极反应为2Na++2e-═2Na,依据电子守恒计算可知,Cl2~2Na在阴极和阳极上析出产物的物质的量之比为2:1,故A正确;
B、硫酸和盐酸都是强酸,体积相同、PH相同,氢离子物质的量相同消耗NaOH的物质的量之比为1:1,故B错误;
C、氨水是弱电解质溶液,浓度不同电离程度不同,氢氧根离子浓度不是2:1,故C错误;
D、依据等物质的量水和乙醇与足量金属钠反应的定量关系,2H2O~H2,2CH3CH2OH~H2,计算得到气体物质的量之比为1:1,故D错误;
故选:A.
本题解析:
本题难度:简单
5、选择题 有关下列装置图的说法正确的是

[? ]
A. 若X是盐桥,则上述装置可以形成原电池
B. 若X是铜条,则上述装置不发生任何反应
C. 若X是铜条,上述装置中,B电极是阴极
D. 若X是铜条,上述装置中,A电极的电极反应式是:Cu2+ + 2e-=Cu
参考答案:C
本题解析:
本题难度:一般