微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关摩尔的使用正确的是(? )
A.1 mol O的质量为16 g·mol-1
B.0.5 mol He约含有6.02×1023个电子
C.2H既可以表示2个氢原子又可以表示2 mol氢原子
D.每摩尔物质均含有6.02×1023个原子
参考答案:B
本题解析:1 mol O的质量为16 g;0.5 mol He含有1 mol e-,约6.02×1023个电子;2H不能表示2 mol H;物质不一定都是由原子构成的。
本题难度:简单
2、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.1 mol羟基与17 g NH3所含电子数都为NA
B.12.4 g白磷(分子式为P4)中含有P—P共价键0.6NA
C.电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32 g
D.适量铜粉溶解于1 L 0.5 mol/L稀硝酸中,当生成2.24 L NO时,溶液中氮原子数为0.4NA
参考答案:B
本题解析:1 mol —OH含电子数为9NA,17 g NH3含电子数为10NA,A项错误;P4是正四面体结构,故12.4 g P4中含P—P键数为 ×6NA=0.6NA,B项正确;电解精炼铜时,粗铜作阳极,在阳极失电子的还有Fe、Zn、Ni等,C项错误;D项中2.24 L NO不一定处在标准状况下,其物质的量就不一定是0.1 mol,错误。
×6NA=0.6NA,B项正确;电解精炼铜时,粗铜作阳极,在阳极失电子的还有Fe、Zn、Ni等,C项错误;D项中2.24 L NO不一定处在标准状况下,其物质的量就不一定是0.1 mol,错误。
本题难度:一般
3、选择题 (1)相同质量的SO2、SO3的物质的量之比为____________;氧原子的个数之比为_ _______。
(2)19 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的摩尔质量是________;A的相对原子质量是____________;ACl2的化学式是__________。
参考答案:(1)5∶4 5∶6 (2)95 g·mol-1 24 MgCl2
本题解析:(1)根据 n=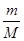 可知,相同质量的SO2、SO3的物质的量之比=
可知,相同质量的SO2、SO3的物质的量之比=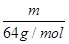 :
: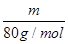 =5∶4;氧原子的个数之比=5×2∶4×3=5∶6。
=5∶4;氧原子的个数之比=5×2∶4×3=5∶6。
(2)19 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的物质的量=0.4mol÷2=0.2mol,因此根据n=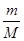 可知,该化合物的摩尔质量M=19.2g÷0.2mol=95 g/mol;氯元素的相对原子质量35.5,所以A的相对原子质量=95-35.5×2=24,因此A是Mg,则该化合物的化学式是MgCl2。
可知,该化合物的摩尔质量M=19.2g÷0.2mol=95 g/mol;氯元素的相对原子质量35.5,所以A的相对原子质量=95-35.5×2=24,因此A是Mg,则该化合物的化学式是MgCl2。
考点:考查物质的量的有关计算、化学式确定
本题难度:一般
4、计算题 (8分)从100ml某种待测浓度的Na2CO3溶液中取出50ml,加入含HCl0.4mol的盐酸溶液,恰好完全反应。
(1)生成CO2的物质的量是多少?
(2)待测Na2CO3溶液的物质的量浓度是多少?
参考答案:(1)0.2mol? (2) 4mol/L
本题解析:(1)2HCl ~ CO2?~? Na2CO3
2mol? 1mol? 1mol
0.4mol? n(CO2 )? n(Na2CO3 )
n(CO2 )="0.2mol?" n(Na2CO3 ) =0.2mol
(2) 待测Na2CO3溶液的物质的量浓度= 0.2mol×(100ml÷50ml)÷0.1L=4mol/L
本题难度:简单
5、选择题 用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.1 mol O3所含有的原子数为3NA
B.18克H2O中,原子数为2NA
C.22.4 L氯化氢所含的原子数为2NA
D.NA个 CH4分子的质量为16g/mol
参考答案:A
本题解析:18克H2O中,原子数为3NA,22.4 L氯化氢不是标准状态,不是1 mol,NA个 CH4分子的质量为16g
本题难度:一般