微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 CuCl2溶液有时呈黄色,有时呈绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡: [Cu(H2O)4]2++4Cl- ?[CuCl4]2-+4H2O
?[CuCl4]2-+4H2O
蓝色 ? 绿色
欲使溶液由绿色变为蓝色,可采用的方法是?
[? ]
A.加NaCl溶液?
B.加水
C.加AgNO3溶液?
D.加NaOH溶液
参考答案:BC
本题解析:
本题难度:一般
2、选择题 如图所示,向A中充入1molX和1molY, 向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器内各自发生下列反应:X(g)+Y(g) 2Z(g)+W(g);△H>0,达到平衡时,
2Z(g)+W(g);△H>0,达到平衡时,
VA=1.2a L。则下列说法不正确的是
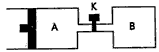
[? ]
A.反应开始时,B容器中化学反应速率快
B.平衡时,A容器中X的转化率为40%,且比B容器内X的转化率大
C.打开K一段时间再次达到平衡时,A的体积为1.6a L(连通管内体积不计)
D.打开K再次达到平衡后,升高温度,A容器体积会增大
参考答案:C
本题解析:
本题难度:一般
3、填空题 下表是部分短周期元素的原子半径和主要化合价。

用化学用语回答:
(1)七种元素中原子半径最大的元素在周期表中的位置___________,M的单质与R的最高价氧化物对应的水化物发生反应的化学方程式为_____________________。
(2)X可与R按1:1的原子个数比形成化合物甲,甲中存在的化学键类型有__________,X可与W组成含18电子的化合物乙,则乙的电子式为_______________。
(3)Y的氢化物比Q的氢化物稳定的根本原因______________________。
(4)在容积不变的密闭容器中进行如下反应:3W2(g)+Y2(g) 2YW3(g),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是_________(填序号)。
2YW3(g),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是_________(填序号)。
A.平衡不发生移动 B.平衡向逆反应方向移动
C.NH3的质量分数增加 D.正逆反应速率都增大
参考答案:(1)第三周期ⅠA族;2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(2)离子键、共价键或非极性共价键; ?
?
(3)氮的非金属性比磷的强
(4)“略”
本题解析:
本题难度:一般
4、简答题 无水氯化铝是一种重要的化工原料,利用明矾石[K2SO4?Al2(SO4)3?2Al2O3?6H2O]制备无水氯化铝的流程如下:
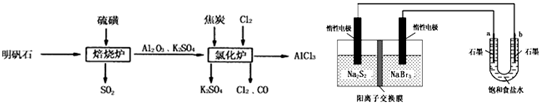
(1)焙烧炉中产生的SO2直接排放到空气中会形成酸雨,若某地酸雨的pH为4.6,在空气中放置一段时间后,pH变为4.0,其原因为______;(用必要的文字简述).
(2)氯化炉中发生的主要反应为:2Al2O3(s)+6Cl2(g)?4AlCl3(g)+3O2(g)△H>0.反应达平衡时,加焦炭能使平衡向正反应方向移动,理由是______.
(3)生产氯化铝的过程中会产生SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少或消除污染.试设计简单实验检验二者是否恰好完全反应.(简要描述实验步骤、现象和结论)______.
仪器自选,可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液?②氯化亚铁溶液?③硫氰化钾溶液?④品红溶液
(4)工业上利用如下装置制备氯气:已知左侧原电池的工作原理为:2Na2S2+NaBr3
Na2S4+3NaBr
①用惰性电极电解饱和食盐水的化学方程式为______.
②如图所示原电池放电时,电池中的Na+向______(填“左槽”或“右槽”)移动.左槽中发生的电极反应式为______.
③该原电池工作一段时间后,测得左槽中Na+物质的量由a?mol变为b?mol,则电解池中b电极上得到的气体在标准状况下的体积为______L(不考虑气体的损失).
参考答案:(1)酸雨中的弱酸亚硫酸被氧化为强酸硫酸,使溶液中的c(H+)增大,pH减小,
故答案为:酸雨中的弱酸亚硫酸被氧化为强酸硫酸,使溶液中的c(H+)增大,pH减小;
(2)焦炭可消耗产物中的氧气,使c(O2)变小;且放出热量,温度升高,导致平衡向正反应方向移动,
故答案为:焦炭可消耗产物中的氧气,使c(O2)变小;且放出热量,温度升高,导致平衡向正反应方向移动;
(3)取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则,二者未完全反应,
故答案为:取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则,二者未完全反应;
(4)①惰性电极电解饱和氯化钠溶液,生成氢气、氯气、氢氧化钠,电解总反应式为:2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑;
②原电池左侧发生氧化反应,为负极,右侧为正极,电解质溶液钠离子向正极移动,即向右槽移动;
由反应2Na2S2+NaBr3?放电?.?Na2S4+3NaBr可知,左侧S22-放电生成S42-,电极反应式为:2S22--2e-=S42-,
故答案为:右槽;2S22--2e-=S42-;
③该原电池工作一段时间后,测得左槽中Na+物质的量由a?mol变为b?mol,则转移电子的物质的量为(a-b)mol,电解池中b电极连接电源的正极,为阳极,得到的气体为氯气,根据电子转移守恒可知氯气的物质的量为你(a-b)mol2,故生成氯气的体积=(a-b)mol2×22.4L/mol=11.2(a-b)L,
故答案为:11.2(a-b).
本题解析:
本题难度:一般
5、选择题 某密闭容器中发生如下反应:X(g)+3Y(g)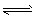 2Z(g)(正反应放热)。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g)(正反应放热)。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是

[? ]
A.t2时加入了催化剂
B.t2时降低了温度
C.t5时增大了压强
D.t4~t5时间内X的转化率最低
参考答案:A
本题解析:
本题难度:一般