微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向含NaBr、KI的溶液里通入过量的氯气,然后将溶液蒸干并灼烧,最终留下的物质是(?)
A.NaCl和KBr
B.KCl和NaBr
C.KCl和NaCl
D.NaCl、KCl和I2
参考答案:C
本题解析:I2易升华,过量Cl2反应后灼烧,留下的一定是金属氯化物。
本题难度:一般
2、选择题 在复印室工作时会闻到一股特殊的气味,离复印机越近,该气味越浓.若用润湿的KI淀粉试纸接近该气体,则试纸会变蓝,则该物质的化学式是
A.Cl2
B.NO2
C.O3
D.N2
参考答案:C
本题解析:在高温放电的条件下氧气转化为臭氧,它有一定的氧化性及气味,可氧化碘离子为碘单质,使润湿的KI淀粉试纸变蓝,答案为C
本题难度:一般
3、选择题 下列关于氯气的叙述,不正确的是( )
A.氯气是一种黄绿色、有毒的气体,而氯离子是无色的
B.氯气和液氯是同一种物质,所含微粒完全相同
C.氯气能与水发生反应,常温下也能与氢氧化钠溶液反应生成两种盐
D.氯气通入石蕊试液,溶液先变红后褪色,说明氯气具有漂白作用
参考答案:A.氯气是一种黄绿色、有刺激性气味、有毒的气体,氯离子是无色的,故A正确;
B.液氯是液态的氯气和氯气是同一种物质,故B正确;
C.氯气能与水反应生成氯化氢和次氯酸,与氢氧化钠发生反应生成氯化钠和次氯酸钠,故C正确;
D.氯气和水反应生成盐酸和次氯酸,溶液呈酸性,向新制氯水中加紫色石蕊试液,溶液呈红色;但次氯酸有漂白性,能使有色物质褪色,所以红色逐渐褪去,起漂白性的物质是次氯酸不是氯气,故D错误.
故选D.
本题解析:
本题难度:一般
4、实验题 某兴趣小组设计并进行了以下实验来探究Cl2、漂白粉的制备及有关性质。
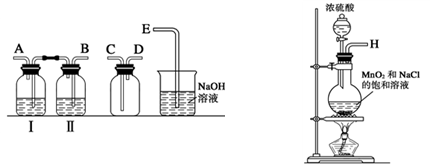
(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:
H→ 、 → 、 → ;广口瓶Ⅱ中的试剂为 。
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:
;
某学生设计如下实验进一步探究SO2与漂粉精的反应:
操作
| 现象
|
取4 g漂粉精固体,加入100 mL水
| 部分固体溶解,溶液略有颜色
|
过滤,测漂粉精溶液的pH
| pH试纸先变蓝(约为12),后褪色
|
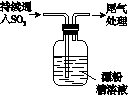
A
| ⅰ.液面上方出现雾状物
ⅱ.稍后,出现浑浊,溶液变为黄绿色
ⅲ.稍后,产生大量白色沉淀,黄绿色褪去
|
?
(3)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(4)该同学推测现象i的雾状物由盐酸小液滴形成,进行如下实验加以进一步验证:
a.用湿润的碘化钾淀粉试纸检验雾状物,无变化;
b.搜集雾状物,用酸化的AgNO3溶液检验,产生白色沉淀。
实验a的目的是 。
(5)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的某些成份之间发生反应。请设计实验方案,进一步确认这种可能性,方案为
。
(6)用化学方程式解释现象ⅲ中黄绿色褪去的原因: 。检验褪色后溶液中是否有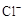 的方法是: ? 。
的方法是: ? 。
参考答案:(1)BACDE? (1分);饱和食盐水(1分)
(2)2Ca(OH)2 +2 Cl2 →Ca(ClO)2 +CaCl2 +2H2O (2分)
(3)碱性、漂白性? (2分)
(4)排除氯气干扰(1分,合理给分)
(5)向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色(1分,合理给分)
(6)SO2 +Cl2 +2H2O → H2SO4 +2HCl? (2分);取样,加入足量的硝酸钡,带沉淀沉积后,取上层清夜,滴入硝酸银与稀硝酸,产生白色沉淀,说明有Cl—。(2分)
本题解析:(1)制备氯气的实验中,要除去杂质氯化氢和水蒸汽,所以用到洗气装置,一般是长进短出,因此顺序为:B A C D E,又因为是先除去混合气中的氯化氢,因此广口瓶Ⅱ中的试剂为饱和食盐水,(氯气在饱和食盐水的溶解度较小)。
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:2Ca(OH)2 +2 Cl2 →Ca(ClO)2 +CaCl2 +2H2O 。
(3)pH试纸颜色先变蓝说明呈碱性,后褪色说明漂粉精有漂白性。
(4)该同学推测现象i的雾状物由盐酸小液滴形成,进行如下实验加以进一步验证:a.用湿润的碘化钾淀粉试纸检验雾状物,无变化目的是排除氯气干扰。
(5)现象ⅱ中溶液变为黄绿色说明有氯气生成,实质是次氯酸根,氯离子在酸性溶液中发生了反应。只要采用不含氯离子的溶液可以进行验证即可,方案为向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色。
(6)ⅲ中黄绿色褪去的原是二氧化硫具有还原性和氯气发生氧化还原反应,SO2 +Cl2 +2H2O → H2SO4 +2HCl。检验褪色后溶液中是否有氯离子的方法是取样,加入足量的硝酸钡,带沉淀沉积后,取上层清夜,滴入硝酸银与稀硝酸,产生白色沉淀,说明有Cl—。2、漂白粉的制备及有关性质。
本题难度:一般
5、填空题 (12分)舍勒发现氯气的的方法至今还是实验室制取氯气的主要方法之一.
(1)请写出实验室制氯气的反应化学方程?,
(2)反应方程式中氧化剂和还原剂物质的量之比为?;其中Cl2是??产物(填氧化或还原);
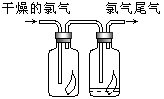
(3)如右图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 ?,从而得出的结论是?.
(4)实验室中剩余的Cl2尾气通常用NaOH溶液吸收,发生反应的离子方程式?。
参考答案:(12分,每空2分)(1)MnO2 + 4HCl(浓)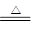 MnCl2 +Cl2↑+ 2H2O;(2)1:2;氧化
MnCl2 +Cl2↑+ 2H2O;(2)1:2;氧化
(3)干燥有色布条不褪色,湿润的有色布条褪条,氯气不具有漂白性,次氯酸具有漂白性。
(4)Cl2 + 2OH-=Cl- + ClO- + H2O
本题解析:(1)实验室用二氧化锰和浓盐酸反应制取氯气,所以实验室制氯气的反应化学方程是MnO2 + 4HCl(浓)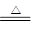 MnCl2 +Cl2↑+ 2H2O。
MnCl2 +Cl2↑+ 2H2O。
(2)根据方程式可知,Mn元素的化合价从+4价降低到+2价,得到2个电子,而氯元素的化合价从-1价升高到0价,失去1个电子,所以氯气是氧化产物,根据电子的得失守恒可知,氧化剂和还原剂的物质的量之比是1:2。
(3)干燥的氯气是没有漂白性的,真正起漂白作用的是次氯酸,所以实验中的现象是干燥有色布条不褪色,湿润的有色布条褪条。因此结论就是氯气不具有漂白性,次氯酸具有漂白性。
(4)氯气有毒需要尾气处理,反应的离子方程式是Cl2 + 2OH-=Cl- + ClO- + H2O。
点评:该题是基础性试题的考查,难度不大。该题的关键是学生要熟练记住氯气的制备原理、氯气的性质,特别是化学性质。另外本题也有利于培养学生的实验安全意识,提高学生的规范操作能力。
本题难度:一般