微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。

已知:
①单质中只有A为金属,在大气层高空释放的蒸气呈现明亮的橙黄色云雾,科学家由此可确定火箭在空中的位置;B、C、D为气体,E为固体;C、E为有色物质。
②B与D可以生成化合物J,A与J反应生成D和另一种化合物K,C与K反应的产物含漂白液的有效成分,F、G、I的水溶液呈碱性。
回答问题:
(1)化合物K的电子式为________。
(2)F的水溶液呈碱性的原因(用离子方程式表示)_________________________________,写出I与J反应的化学反应方程式__________________________________________。
(3)实验室制备C的离子反应方程式为_____________________________。
(4)D在C中燃烧观察到的现象是_________________________________。
(5)可利用B与D生成化合物J的反应制成燃料电池,若1 g D在B中燃烧生成气态J时,放出120.9 kJ的热量,已知1 mol J 在汽化时吸热44.0 kJ,写出表示D的燃烧热的热化学方程式_____________________________________________________,利用K作电解质溶液,写出该燃料电池的负极的电极反应方程式________________________。
参考答案:(1) 
(2)S2-+H2O?HS-+OH- NaH+H2O=H2↑+NaOH
(3)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(4)苍白色火焰
(5)H2(g)+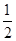 O2(g)=H2O(l) ΔH=-285.8 kJ/mol
O2(g)=H2O(l) ΔH=-285.8 kJ/mol
2H2-4e-+4OH-=4H2O
本题解析:由金属A在大气层高空释放的蒸气呈现明亮的橙黄色云雾可判断A可能为金属钠;E为有色固体,则E为单质硫,F为硫化钠;C为有色气体单质,且C与K反应的产物含漂白液的有效成分,则C为氯气,K为氢氧化钠,由此可推知B、D、J分别为氧气、氢气和水,故I为氢化钠、G为氧化钠或过氧化钠,H为氯化钠。
(5)1 g H2在O2中燃烧生成气态水放出120.9 kJ的热量,则1 mol H2在O2中燃烧生成1 mol气态水放出241.8 kJ的热量,1 mol气态水液化时又放出44.0 kJ热量,故1 mol H2在O2中燃烧生成1 mol液态水共放出285.8 kJ的热量,则其热化学方程式为:H2(g)+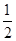 O2(g)=H2O(l) ΔH=-285.8 kJ/mol。写电极方程式时,注意其电解质溶液为碱性溶液。
O2(g)=H2O(l) ΔH=-285.8 kJ/mol。写电极方程式时,注意其电解质溶液为碱性溶液。
本题难度:困难
2、填空题 A、B、C、D均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):
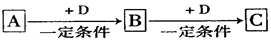
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为?(填元素符号)
(2)若D是金属,C溶液在储存时应加入少量D,其理由是(用必要的文字和离子方程
式表示)?;D在潮湿的空气中易发生吸氧腐蚀,写出腐蚀时原电池正极的电极反应式?。
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式?。化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E 的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示。则固体混合物中Mg的质量为?;NaOH溶液的物质的量浓度为?。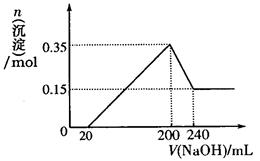
参考答案:(1)Na(1分)
(2)加入少量铁,防止Fe2+被氧化为Fe3+(1分);2Fe3++Fe = 3Fe2+(1分)
O2+2H2O+4e— = 4OH—(1分)
(3)Al(OH)3+3H+ = Al3++3H2O (1分)Al(OH)3+OH—= AlO2—+2H2O(1分)
3.6g(2分)? 5mol·L—1(2分)
本题解析:(1)若D是具有氧化性的单质,则属于主族的金属A应该是钠,B是氧化钠,D是过氧化钠。
(2)若D是金属,C溶液在储存时应加入少量D,则D是铁。由于亚铁离子具有还原性,易被氧化生成铁离子,而单质铁能还原铁离子,方程式为2Fe3++Fe = 3Fe2+;钢铁发生吸氧腐蚀时,正极是氧气得到电子,方程式为O2+2H2O+4e— = 4OH—。
(3)根据题意可知,金属应该是铝,所以B是氢氧化铝,而C可能是Al3+,也可能是AlO2-,所以B生成C的方程式为Al(OH)3+3H+ = Al3++3H2O 、Al(OH)3+OH—= AlO2—+2H2O;
(4)E是Al,所以根据图像可知,硫酸是过量的,则0~20ml氢氧化钠是中和硫酸的,20~200ml是沉淀镁离子和铝离子的;200~240ml是溶解氢氧化铝的。因此0.15mol是氢氧化镁沉淀,则镁的质量是0.15mol×24g/mol=3.6g;氢氧化铝是0.2mol,则溶解0.2mol氢氧化铝消耗的氧化钠是0.2mol,所以氢氧化钠溶液的浓度是0.2mol÷0.04L=5.0mol/L。
本题难度:一般
3、填空题 (16分)已知A为金属单质,它们之间能发生如下反应(部分产物未标出)
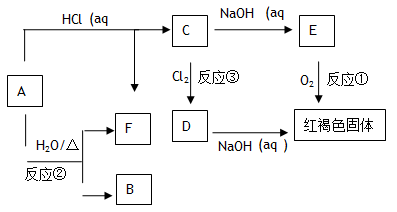
请根据以上信息回答下列问题:
(1)(每空1分)写出物质B的化学式:?、C的化学式?、D的化学式? ?、E的化学式?
?、E的化学式?
(2)写出下列反应的化学方程式(如果是氧化还原反应请标出单线桥)(方程式每个2分,单线桥每个2分):
反应①?
反应②?
反应③?
参考答案:

本题解析:略
本题难度:简单
4、推断题 A、B、C均为中学化学常见的单质,其中一种是金属,通常状况下,A为固体,B为黄绿色气体,C为气体,其余均为化合物,X是一种常用的具有挥发性的无氧强酸,E为黑色固体,H为无色液体,它们之间的转化关系如图(其中某些反应条件和产物已略去)。
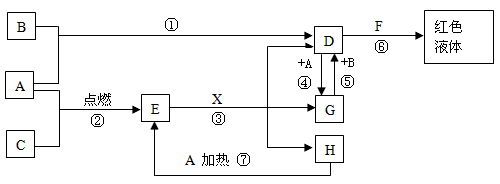
(1)写出:A的化学式__________ ,F的化学式____________ 。
(2)在反应①~⑦中,不属于氧化还原反应的是 ___________(填序号)。
(3)完成:E和X反应的离子方程式:________________ ;
(4)完成H和某种化合物快速制C的化学方程式_________ ,每生成0.15molC电子转移 _________mol。
(5)B蒸气与过量氨气混合有白烟及另一种气体单质产生,该反应的化学方程式为:___________ 。
参考答案:(1)Fe ; KSCN(或NH4SCN)
(2)③⑥
(3)Fe3O4+8H+==Fe2++2Fe3++4H2O
(4)2Na2O2+2H2O==4NaOH+O2↑ ;0.3
(5)3Cl2+8NH3=6NH4Cl+N2
本题解析:
本题难度:一般
5、简答题 短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1:1的离子化合物A,X与Z能形成原子个数比为1:1的共价化合物B,它们之间能实现如图所示转化(部分产物已略去):
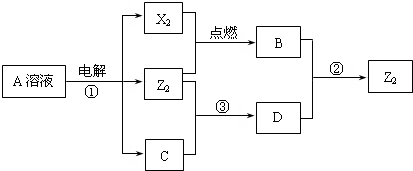
(1)Y在周期表的位置是第三周期第IA族第三周期第IA族;Z2的结构式是Cl-ClCl-Cl;
(2)反应①的离子方程式是2Cl-+2H2O

2OH-+Cl2↑+H2↑2Cl-+2H2O

2OH-+Cl2↑+H2↑;
(3)D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应.某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如图所示(夹持固定装置的仪器已略去).

I、写出反应②的离子方程式ClO-+Cl-+2H+=Cl2↑+H2OClO-+Cl-+2H+=Cl2↑+H2O;
II、上述实验装置不够完善,改进方法是在a、b装置之间加一盛有饱和食盐水的洗气瓶,除去HCl在a、b装置之间加一盛有饱和食盐水的洗气瓶,除去HCl;
Ⅲ、足量Z2?通入FeBr2溶液中发生反应的离子方程式是2Fe2++4Br-+3Cl2=6Cl-+2Fe3++2Br22Fe2++4Br-+3Cl2=6Cl-+2Fe3++2Br2.
参考答案:短周期元素X、Y、Z的原子序数依次增大,Y与Z能形成离子个数比为1:1的离子化合物A,电解A溶液可得X2、Z2单质及C,有三种物质生成,其中两种单质,为双原子分子,应为电解水与电解质型的电解,则A为盐溶液,该盐溶液盐的阳离子不能放电,酸根离子放电,则A可能为NaCl,则Y为钠元素,Z为氯元素;X和Y同主族,且X的原子序数较小,X与Z能形成原子个数比为1:1的共价化合物,则X为氢元素.
若A为NaCl,电解NaCl溶液可得H2、Cl2单质及NaOH,H2与Cl2反应生成HCl,即B为HCl,氯气能与氢氧化钠反应生成次氯酸钠,则X2 为H2,Z2为Cl2,次氯酸钠能与HCl反应生成氯气.故符合题意.
所以X为氢元素,Y为钠元素,Z为氯元素;X2 为H2,Z2为Cl2,B为HCl,C为NaOH,D为NaClO.
(1)Y为钠元素,原子核外有3个电子层,最外层有1个电子,处于周期表第三周期第IA族;Z2为Cl2,氯原子之间形成1对共用电子对,结构式为Cl-Cl.
故答案为:第三周期第IA族;Cl-Cl.
(2)反应①为电解氯化钠溶液,生成氢气、氯气与氢氧化钠,反应的离子方程式是2?Cl-+2H2O?电解?.?2OH-+Cl2↑+H2↑.
故答案为:2?Cl-+2H2O?电解?.?2OH-+Cl2↑+H2↑.
(3)I、反应②是盐酸与次氯酸钠反应,生成氯化钠、氯气与水,反应的离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O.
故答案为:ClO-+Cl-+2H+=Cl2↑+H2O
II、由于盐酸具有挥发性,上述实验装置制取的氯气中含有氯化氢,应在a、b装置之间加一盛有饱和食盐水的洗气瓶,除去HCl.
故答案为:在a、b装置之间加一盛有饱和食盐水(或水)的洗气瓶,除去HCl.
Ⅲ、氯气具有强氧化性,足量氯气将亚铁离子、溴离子氧化为铁离子、溴单质,足量Cl2?通入FeBr2溶液中发生反应的离子方程式是2?Fe2++4Br-+3Cl2=6Cl-+2?Fe3++2Br2.
故答案为:2?Fe2++4Br-+3Cl2=6Cl-+2?Fe3++2Br2.
本题解析:
本题难度:一般