微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 反应:N2(g)+3H2(g) 2NH3(g) △H<0。在等容条件下进行。体系中各物质浓度随时间变化的曲线如图所示,回答问题:
2NH3(g) △H<0。在等容条件下进行。体系中各物质浓度随时间变化的曲线如图所示,回答问题:
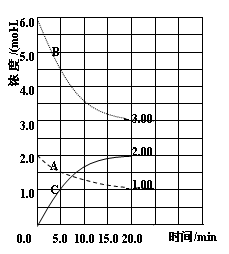
(1)图中B为 (填“N2”、“H2”或“NH3”)计算反应从开始→达平衡时H2的反应速率v(H2)=
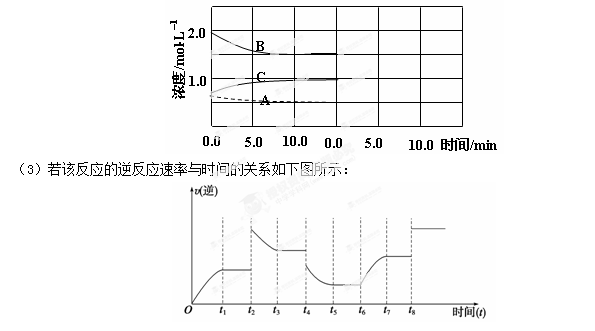
(2)下图是在某温度下反应达到平衡,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示体系中各物质的浓度随时间变化的趋势(不需计算新平衡时的具体浓度,只要新平衡时浓度处于一个合理范围内即可。曲线上必须标出N2、H2、NH3)。
反应在t1、t3、t5、t7时都达到了平衡,而t2、t4、t6、t8时都改变了条件,试判断改变的条件是(填“升温”、“降压”……
参考答案:
本题解析:
本题难度:困难
2、选择题 一定条件下,在某一密闭容器中发生如下反应:N2 (g)+3H2 (g) 2NH3 (g)。下列有关该反应的说法中,正确的是
2NH3 (g)。下列有关该反应的说法中,正确的是
[? ]
A.降低温度可加快反应速率
B.使用催化剂可加快反应速率
C.平衡时,N2能完全转变成NH3
D.平衡时,正反应和逆反应均停止
参考答案:B
本题解析:
本题难度:一般
3、填空题 汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。汽车尾气中CO、NO2气体在一定条件下可以发生反应:4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH="-1" 200 kJ·mol-1
4CO2(g)+N2(g) ΔH="-1" 200 kJ·mol-1
(1)恒温恒容条件下,不能说明该反应已达到平衡状态的是?(填字母,下同)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.2v(NO2)逆=v(N2)正
D.容器内混合气体密度保持不变
(2)能使该反应的反应速率增大,且平衡向逆反应方向移动的是?。
A.及时分离出CO2
B.适当升高温度
C.减小容器体积使体系压强增大
D.选择高效催化剂
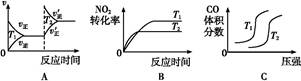
(3)对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是?。
参考答案:(1)CD (2)B (3)B
本题解析:(1)恒温恒容下,混合气体颜色不再变化说明NO2浓度不再改变,能说明反应已达平衡;由于该反应是气体分子数减小的反应,容器内的压强保持不变,意味着气体分子总数不再改变,能说明反应已达平衡;2v逆(NO2)=v正(N2)说明反应未达平衡,反应体系中物质全为气体,气体总质量不变,在恒容条件下容器内混合气体密度一直保持不变,故密度不变,不能说明反应已达平衡。(2)分离出CO2导致反应物浓度减小,会使该反应的反应速率减小且平衡向正反应方向移动,A错;因ΔH<0,升温能使反应速率增大,平衡逆向移动,B对;该反应气体分子数减少,减小容器体积,体系压强增大导致平衡正向移动,C错;催化剂不影响化学平衡,D错。(3)升温,正、逆反应速率应同时增大,A错;升温能使反应速率增大,且由于正向反应为放热反应,升温导致平衡逆向移动,NO2转化率降低,B对;由反应特点可知,增大压强平衡右移,CO的体积分数应该减小,升高温度平衡左移,CO的体积分数应该增大,故C错。
本题难度:一般
4、选择题 一定量的Zn与足量的稀盐酸反应制氢气,为了加快制取氢气的速率且不影响制得氢气的量,向稀盐酸中加入下列物质:①石墨粉②CuO ③Pt粉④Cu粉⑤Fe粉,
其中可行的是
A.①②③④⑤
B.①③⑤
C.①③④⑤
D.①③④
参考答案:D
本题解析:考查外界条件对反应速率的影响。在其它条件不变的情况下,增大反应物浓度或升高温度或使用催化剂或增大反应物的接触面积或通过原电池反应等均可以加快反应速率。①③④均是构成原电池。氧化铜可以和盐酸反应生成氯化铜,然后锌置换出铜,构成原电池加快反应速率,但由于消耗了锌,使用生成的氢气减少。铁是活泼的金属和盐酸反应生成氢气,增大氢气的体积,使用答案只能是D。
本题难度:一般
5、选择题 一定量的稀盐酸跟过量锌粉反应时,为了减缓反应速率又不影响生成H2的总量,可采取的措施是
A.加入少量稀NaOH溶液
B.加入少量CH3COONa固体
C.加入少量NH4HSO4固体
D.加入少量Na2CO3浓溶液
参考答案:B
本题解析:“减缓反应速率”则氢离子的浓度应减小;而“又不影响生成H2的总量”则氢离子的总量应保持不变,故答案为B。
点评:本题考查影响反应速率的因素,属于基础题。熟记影响反应速率的因素即可解答。
本题难度:一般