微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 目前,世界上生产的镁有60%来自海水,其生产流程图如下
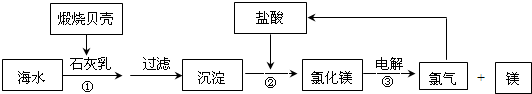
(1)贝壳的主要化学成分为______(写化学式);
(2)写出反应②的离子方程式:______
(3)写出Mg与CO2反应的化学方程式,并标出电子转移的方向与数目:______其中还原剂是______
(4)电解氯化镁所得的氯气除用于生产盐酸外,请举出氯气在工业上的另一种用途(用化学方程式表示)
______.
参考答案:煅烧贝壳发生的反应为CaCO3高温.CO2↑+CaO,氧化钙和水反应制得石灰乳,反应方程式为:CaO+H2O=Ca(OH)2,镁离子和石灰乳反应生成氢氧化镁沉淀,离子方程式为:Mg2++2OH-=Mg(OH)2↓,氢氧化镁和稀盐酸反应生成氯化镁,反应方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,电解熔融氯化镁制得Mg,反应方程式为:MgCl2(熔融)电解.Mg+Cl2↑,氢气在氯气中燃烧得到氯化氢,反应方程式为H2+Cl2=2HCl,
(1)贝壳的主要成分是碳酸钙,其化学式为CaCO3,故答案为:CaCO3;
(2)氢氧化镁和稀盐酸发生复分解反应生成氯化镁和水,离子反应方程式为:Mg(OH)2+2H+═Mg2++2H2O,
故答案为:Mg(OH)2+2H+═Mg2++2H2O;
(3)镁在二氧化碳中燃烧生成氧化镁和碳,该反应中Mg元素化合价由0价变为+2价、C元素化合价由+4价变为0价,转移电子数为4, ,该反应中的还原剂是Mg,
,该反应中的还原剂是Mg,
故答案为: ;Mg;
;Mg;
(4)氯气是制备漂粉精的主要原料,发生的反应为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O.
本题解析:
本题难度:一般
2、简答题 海水是地球的元素宝库,即便在提取氯化钠、溴、镁后的“废液”中,仍然可以提取有用物质,如碘.应用这种“废液”提取碘的工艺流程如图所示.

(1)步骤③加铁粉的目的是______.
(2)写出步骤④中反应的离子方程式:______.
(3)上述生产流程中,可以循环利用的副产物是______.
(4)操作⑤的名称是______,选用的试剂是______.
参考答案:(1)根据流程图可知步骤③加铁粉的目的是铁与碘化银转化成碘化亚铁和单质银;
故答案为:使碘化银转化成碘化亚铁和单质银;
(2)氯气能氧化Fe2+和I-分别生成Fe3+和I2,离子方程式为:2Fe2++4I-+3Cl2=2I2+2Fe3++6Cl-;
故答案为:2Fe2++4I-+3Cl2=2I2+2Fe3++6Cl-;
(3)根据流程图可以看出,Ag可以循环利用;
故答案为:Ag;
(4)碘在水中的溶解度小,可用CCl4萃取出水溶液中的碘,然后分液;
故答案为:萃取、分液;CCl4;
本题解析:
本题难度:一般
3、选择题 海水资源的开发利用之一是海水的淡化。下图是海水淡化原理示意图,则这种海水淡化方法所应用的原理是

[? ]
A.蒸馏
B.萃取
C.离子交换
D.结晶
参考答案:A
本题解析:
本题难度:简单
4、填空题 工业上对海水资源综合开发利用的部分工艺流程如下图所示。

(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽。离子膜和隔膜均允许通过的分子或离子是
________。电解槽中的阳极材料为__________。
(2)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4顺序制备?
_____原因是_________________________。
(3)溴单质在四氧化碳中的溶解度比在水中大得多,四氧化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氯化碳,原因是____________________________。
参考答案:(1)阴离子(Na+);钛(或石墨)
(2)否;如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯
(3)四氯化碳萃取法工艺复杂、设备投资大,经济效益低、环境污染严重
本题解析:
本题难度:一般
5、选择题 溴是海水中重要的非金属元素.地球上90%的溴元素以?的形式存在于海水中,所以人们称溴为“海洋元素”。下列有关说法中正确的是
[? ]
A.从海水中提取溴时,不?涉及氧化还原反应?
B.苯与溴水反应生成溴苯?
C.可以用直馏汽油萃取溴水中的溴?
D.向FeBr2溶液中通入Cl2时,一定会发生如下反应:? ?
?
参考答案:C
本题解析:
本题难度:简单