微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是______(填字母)。
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2) Mn和Fe的部分电离能数据如下表
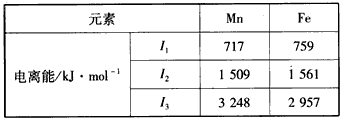
Mn元素价电子排布式为_______________,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是_________________________。
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于________区。
(4)Ti的一种氧化物X,其晶胞结构如下图所示,则X的化学式为____________。

(5)电镀厂排放的废水中常含有剧毒的CN-,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2
①H、C、N、O四种元素的电负性由小到大的顺序为___________________
②与CNO-互为等电子体的微粒的化学式为_______________ (写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式:_______________。
参考答案:(1)AD
(2)3d54s2;Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态)
(3)d区
(4)TiO2
(5)①H<C<N<O;②CO2(N2O)、SCN-;③N C-O-H
C-O-H
本题解析:
本题难度:一般
2、选择题 化学反应的发生不仅与物质的性质有关,还与反应物质的浓度、反应温度、相对量的多少等因素有关。下列各组的两物质中,不论在何种反应条件下,只要是能发生反应,就只能发生一个化学反应的是
A.Cu与HNO3溶液
B.CO2与NaOH溶液
C.Zn与H2SO4溶液
D.Fe2O3与HCl溶液
参考答案:D
本题解析:A中如果是稀硝酸,则生成NO,如果是浓硝酸,则生成NO2;B中如果CO2过量,则生成碳酸氢钠,如果氢氧化钠过量,则生成碳酸钠;C中如果是稀硫酸,则生成氢气,如果是浓硫酸,则生成SO2;D中生成物始终是氯化铁和水,答案选D。
点评:该题是基础性试题的考查,试题难易适中,注重基础,兼顾能力的考查。该题的关键是熟练记住常见物质的化学性质,然后灵活运用即可,学生不难得分。
本题难度:简单
3、选择题 下列比较关系与排列顺序错误的是
A.酸性 H4SiO4<H3PO4<H2SO4<HClO4
B.碱性 Ca(OH)2>Mg(OH)2>Al(OH)3
C.稳定性SiH4>NH3>H2O>HF
D.半径 O2->F->Mg2+>Al3+
参考答案:C
本题解析:非金属性越强,最高价氧化物的水化物的酸性越强,相应氢化物的稳定性越强,所以A正确,C不正确,同样金属性越强,最高价氧化物的水化物的碱性越强,所以B正确。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,D正确。答案选C。
本题难度:困难
4、填空题 W、X、 Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为 18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。

?(1)X位于元素周期表中第____周期第____族;
(2)Z的气态氢化物和溴化氢相比,较稳定的是____(写化学式)。
参考答案:(1)三 ;IA
(2)HCl
本题解析:
本题难度:一般
5、填空题 根据周期表对角线规则,金属Be与Al单质及其化合物性质相似,又已知AlCl3熔沸点较低,易升华.试回答下列问题:
(1)BeCl2是______化合物(填写离子化合物或共价化合物);
(2)Be(9H)2与Mg(9H)2可用______试剂鉴别,其离子反应方程式为______.
参考答案:(手)氯化铝是共价化合物,金属Be与Al单质及其化合物性质相似,所以BeCl2是共价化合物,故答案为:共价;
(2)氢氧化铝能和氢氧化钠反应,铝和铍处于对角线位置,性质具有相似性,所以Be(OH)2与氢氧化钠能反应,而氢氧化镁和氢氧化钠不反应,可以用氢氧化钠鉴别Be(OH)2与Mg(OH)2,氢氧化铍和氢氧化钠反应的离子反应方程式为Be(OH)2+2OH-═BeO22-+2H2O,故答案为:Be(OH)2+2OH-═BeO22-+2H2O.
本题解析:
本题难度:一般