微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将液体A滴入烧瓶与气体B充分反应,打开夹子,可发现试管内的水立刻沸腾了,则液体A和气体B的组合不可能是

A.水、氯化氢
B.硫酸、氨气
C.氢氧化钠溶液、二氧化硫
D.氢氧化钠溶液、一氧化碳
参考答案:D
本题解析:将液体A滴入烧瓶与气体B充分反应,打开夹子,可发现试管内的水立刻沸腾了,这是由于压强减小,沸点降低,因此分析选项中气体的压强减小、物质的量减小即可,以此来解答。A、HCl极易溶于水,压强减小,沸点降低,符合题意,故A不选;B、硫酸与氨气反应生成硫酸铵固体,压强减小,沸点降低,符合题意,故B不选;C、氢氧化钠溶液与二氧化硫反应生成亚硫酸钠溶液、水,压强减小,沸点降低,符合题意,故C不选;D、氢氧化钠溶液与一氧化碳不反应,不会导致压强减小,不符合题意,故D选,答案选D。
本题难度:一般
2、填空题 香料Ⅴ的制备方法如下:

(1)化合物I的分子式为?,Ⅳ中含氧官能团的名称是?。
(2)化合物I可由 经两步反应制得,写出第一步反应的化学方程式?。
经两步反应制得,写出第一步反应的化学方程式?。
(3)1mol的化合物II和Ⅲ分别与H2反应,最多消耗H2的物质的量之比为?。
(4)该工艺中第①步的目的是?。为检验①中CH3I的碘原子,实验室的操作是:取少量CH3I于试管中,加入足量的NaOH水溶液,加热充分反应,冷却后加入?,再加入少量硝酸银溶液。
(5)芳香化合物Ⅵ是Ⅲ的一种无甲基同分异构体,能发生水解反应和银镜反应,Ⅵ的结构简式为?。
(6)一定条件下,化合物Ⅳ与乙二醇发生类似反应④的反应,该有机产物的结构简式为?。
参考答案:(1)C7H8O2(2分),羟基和醛基(2分)
(2) (2分)
(2分)
(3)3:4(2分)
(4)保护酚羟基,防止化合物Ⅰ氧化制醛时氧化酚羟基(2分)。加入稀硝酸(1分)至酸性(1分)。或加入足(过)量(1分)稀硝酸(1分)。
(5) (2分)
(2分)
(6) 或者
或者 (2分)
(2分)
本题解析: (1)根据I的结构简式很容易得出其分子式为C7H8O2 ;IV中的含氧官能团是醛基和酚羟基。
(2)化合物I由 制备,主要是Cl原子在碱性水溶液中被OH取代,形成醇羟基,因为酚羟基有弱酸性,所以在碱性条件下要反应生成酚纳盐,所以要得到I,还需酸化。因此制备总共经过两步反应,那么第一步的反应的化学方程式就是:
制备,主要是Cl原子在碱性水溶液中被OH取代,形成醇羟基,因为酚羟基有弱酸性,所以在碱性条件下要反应生成酚纳盐,所以要得到I,还需酸化。因此制备总共经过两步反应,那么第一步的反应的化学方程式就是:
(3)化合物III比化合物II侧链多了一个-CHO,因此能多消耗H21mol,所以消耗H2的物质的量之比为3:4。
(4)工艺中反应②是氧化反应,因此第一步的目的是保护酚羟基,防止其被氧化;CH3I的I原子与C原子以共价键的形式连接,因此要检验I原子,要让CH3I在碱性条件下水解,再用硝酸酸化,后加硝酸银溶液,若出现黄色沉淀,证明含有I原子。
(5)III的同分异构体VI不含有-CH3,而能够发声水解,说明含有酯基,且能发生银镜反应,则构成的是甲酸某酯的结构(-O-CHO),因此满足条件的VI的结构简式为 。
。
(6)从反应④的产物来看,化合物IV中的醛基和2分子的乙醇分子发生反应,形成两个C-O单键,因此若把2分子的乙醇换成乙二醇,则反应会按1:1或2:2进行,乙二醇中的2个羟基均反应,所以该有机物的结构简式为 或
或 。
。
本题难度:一般
3、选择题 学生甲和学生乙完成了下列实验,其中实验现象完全相同的是
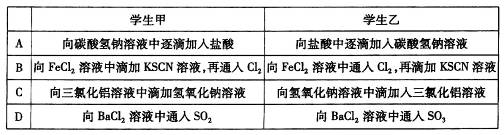
参考答案:A
本题解析:A、均发生碳酸氢根离子与氢离子的反应,均观察到气泡生成,故A正确;B、向FeCl2溶液中滴加KSCN溶液,再通入Cl2先不变色后变红,向FeCl2溶液中通入Cl2,再滴加KSCN溶液变红色,现象不同,故B错误;C、向三氯化铝溶液中滴加氢氧化钠溶液先生成沉淀后沉淀消失,而向氢氧化钠溶液中滴加入三氯化铝溶液,开始没有沉淀后生成沉淀,现象不同,故C错误;D、向BaCl2溶液中通入SO2不反应,向BaCl2溶液中通入SO3反应生成硫酸钡沉淀,现象不同,故D错误。
本题难度:一般
4、选择题 “封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是

A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差
B.加热时,②、③中的溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅(已知:2NO2(g) N2O4(g)△H<0)
N2O4(g)△H<0)
D.四个“封管实验”中都有可逆反应发生
参考答案:C
本题解析:A、上部聚集碘是因为碘易升华,物理性质,不是热稳定性,故A错误;B、②中为红色溶液,加热氨气逸出,溶液变无色,③中二氧化硫使品红溶液褪色,溶液为无色,加热,无色化合物分解,二氧化硫逸出,溶液变红色,故B错误;C、热水中温度升高,平衡向左移动,二氧化氮的浓度增大,颜色加深,浸泡在冷水中,温度降低,平衡向右移动,二氧化氮的浓度减小,颜色变浅,故C正确;D、①中发生的是物理变化,故没有可逆反应发生,D错误。故选C。
本题难度:一般
5、填空题 下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
主族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族
2
①
②
③
3
④
⑤
⑥
⑦
⑧
4
⑨
|
(1)在这些元素中,化学性质 的是:______
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是______,碱性最强的化合物的是:______.
(3)最高价氧化物是两性氧化物的元素是______;写出它的氢氧化物与氢氧化钠反应的离子方程式______.
(4)用电子式表示元素④与⑥的化合物的形成过程:______,该化合物属于______(填“共价”或“离子”)化合物.
(5)表示①与③的化合物的电子式______,该化合物是由______(填“极性”“非极性”下同)键形成的.
参考答案:根据元素在周期表中的分布,可以推知①是C,②是N,③是O,④是Na,⑤是Al,⑥是S,⑦是Cl,⑧是Ar,⑨是K.
(1)在这些元素中,化学性质最稳定的是稀有气体Ar,故答案为:Ar;
(2)根据元素周期律:同周期元素的原子,从左到右最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱,同主族元素的原子,从下到上最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱可以推知酸性最强的式是高氯酸,碱性最强的是KOH,故答案为:HClO4;KOH;
(3)氢氧化铝是两性氢氧化物,所以最高价氧化物是两性氧化物的元素是Al,能和强碱反应生成盐和水,实质是:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al;Al(OH)3+OH-=AlO2-+2H2O;
(4)硫化钠是硫离子和钠离子之间通过离子键形成的离子化合物,形成过程为:
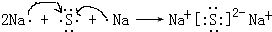
,故答案为:
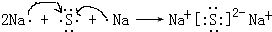
;离子;
(5)二氧化碳是碳原子和氧原子间通过极性共价键形成的共价化合物,电子式为:
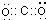
,故答案为:
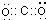
;极性.
本题解析:
本题难度:一般