微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 无论是传统的或是新型的无机非金属材料,硅元素都占有非常重要的地位.由于硅在太阳能发电中的重要作用,有些科学家称硅是“二十一世纪的能源”.下列关于硅的说法不正确的是( )
A.自然界中硅单质和含量居各元素的第二位
B.高纯度的硅是制半导体的重要材料
C.水泥、玻璃、陶瓷都是传统的硅酸盐工业产品
D.二氧化硅可用于作光导纤维
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列有关硅元素的叙述中,正确的是( )
A.SiO2不溶于水,也不溶于任何酸
B.SiO2是良好的半导体材料
C.硅是地壳中含量最多的元素
D.水玻璃可用作木材防火剂
参考答案:A.SiO2能溶于氢氟酸,故A错误;
B.SiO2不是半导体材料,故B错误;
C.地壳中含量最多的元素是氧,故C错误;
D.水玻璃是矿物胶,不燃烧,而将硅酸钠涂在木材表面就阻隔了木材与空气中氧气的直接接触,可用作制备木材防火剂的原料,故D正确.
故选D.
本题解析:
本题难度:简单
3、实验题 某研究性学习小组进行了“实验室制Si”的研究,他们以课本为基础,查阅资料得到以下可供参考的信息:
①工业上?在高温时用C还原SiO2可制得Si;
②Mg在点燃的条件下按质量比8∶5与SiO2反应生成一种白色固体化合物和另一种硅化物;
③金属硅化物与稀硫酸反应生成硫酸盐与SiH4;
④Si和SiO2均不能与稀H2SO4反应;
⑤SiH4在空气中自燃。他们的研究报告中记载着“……选用合适的物质在适合的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥、最后称量……在稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期的63%左右。”
请回答下列问题:
(1)该小组“实验室制Si”的化学反应方程式是____________________________。
(2)写出②的反应方程式:________________________。
(3)该过程中产率比预期低的原因是__________________________。
(4)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是什么?请用必要的文字和化学方程式予以说明:____________________________________________________________________________________________________。
参考答案:(1)2C+SiO2 Si+2CO↑
Si+2CO↑
(2)SiO2+4Mg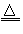 2MgO+Mg2Si
2MgO+Mg2Si
(3)部分硅与镁反应生成了硅化镁
(4)SiH4能自燃,而有爆鸣声和火花就是由SiH4的自燃引起的,SiH4+2O2===SiO2+2H2O
本题解析:
本题难度:一般
4、填空题 近日,“杭州创造”首届十大创新成就评选发布晚会上,浙江省富通集团光纤预制棒项目赢得十大创新成就殊荣。光纤预制棒是光缆生产的最“源头”项目,目前国内光缆生产厂家约200家,大部分靠买进口光纤预制棒来生产光缆。
(1)光纤预制棒的化学成分是___________,晶体类型为__________。
(2)如果把光缆裸露在碱性土壤中,结果会短路,用离子方程式说明原因__________________。
(3)下列说法正确的是_______
A、石英玻璃与普通玻璃都是硅酸盐制品
B、二氧化硅是良好半导体材料
C、工艺师用盐酸刻蚀石英制作艺术品
D、石英与二氧化碳化学键相同
(4)石英可以制备各种各样的陶瓷制品,如坩埚、蒸发皿、氮化硅高温结构陶瓷等。写出氮化硅的化学式__________,工业上用石英、焦碳、氮气制备氮化硅,写出反应方程式___________________。
(5)晶体硅是电子工业的重要材料,工业上大量的晶体硅是由石英为原料制备得到的。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3;
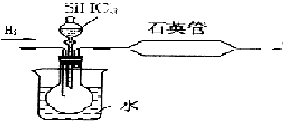
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。
其中用SiHCl3与过量H2反应制备纯硅的装置如下(热源装置略去):
为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。装置C中的烧瓶需要加热,其目的是:_______________。装置D中发生反应的化学方程式为____________________。
参考答案:(1)SiO2;原子晶体
(2)SiO2 + 2NaOH = Na2SiO3 + H2O
(3)D
(4)Si3N4; 3SiO2 + 2N2 + 6C = Si3N4 + 6CO
(5)排尽装置中的空气;使滴入烧瓶中的SiHCl3气化;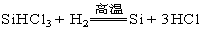
本题解析:
本题难度:一般
5、简答题 硅藻土由无定形的SiO2组成,含有少量Fe2O3、Al2O3及有机物等杂质.通常呈浅黄色或浅灰色,质软多孔.工业上可按如下流程,用硅藻土制备纳米二氧化硅.
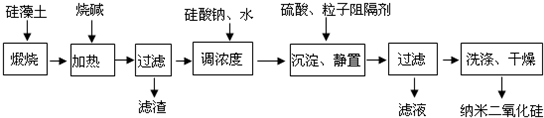
(1)煅烧硅藻土的目的是______
(2)在加热条件下加入烧碱时反应的化学方程式为______.
(3)加入过量硫酸后生成沉淀的反应方程式为______.
(4)上述流程中,有助于控制二氧化硅粒子直径的措施有______(至少写出一个).
参考答案:(1)硅藻土中含有少量Fe2O3、Al2O3及有机物等杂质,除去有机杂质可以采用煅烧的方法,故答案为:除去有机杂质;
(2)二氧化硅和氧化铝均能和强碱反应,方程式为:SiO2+2NaOH═Na2SiO3+H2O,Al2O3+2NaOH═2NaAlO2+H2O,故答案为:SiO2+2NaOH═Na2SiO3+H2O,Al2O3+2NaOH═2NaAlO2+H2O;
(3)化学反应遵循强酸制弱酸的规律,所以H2SO4能和Na2SiO3反应,方程式为:Na2SiO3+H2SO4═Na2SO4+H2SiO3↓,故答案为:Na2SiO3+H2SO4═Na2SO4+H2SiO3↓;
(4)根据图示的流程,当沉淀时加入粒子阻隔剂(或加入硅酸钠和水调浓度)可以控制二氧化硅粒子直径,故答案为:沉淀时加入粒子阻隔剂(或加入硅酸钠和水调浓度).
本题解析:
本题难度:一般