微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为 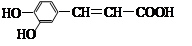 ?。有关咖啡酸的说法中不正确的是
?。有关咖啡酸的说法中不正确的是
A.咖啡酸可以发生还原、取代、加聚等反应
B.咖啡酸与FeCl3溶液可以发生显色反应
C.1 mol咖啡酸可与4 mol H2发生加成反应
D.1 mol咖啡酸最多能消耗3 mol的NaHCO3
参考答案:D
本题解析:有机物含有的官能团为酚羟基、羧基、碳碳双键。A、碳碳双键发生加氢还原、加聚,羟基和羧基可发生取代反应,正确;B、含有酚羟基,正确;C、苯环消耗3mol,碳碳双键消耗1mol,正确;D、NaHCO3只与羧基反应,消耗1mol,错误。
本题难度:一般
2、简答题 某有机物的化学分析结果记录如下:
①相对分子质量为134,完全燃烧后只生成CO2和水,
②134g该有机物与足量的NaHCO3反应放出44.8L CO2,等质量该有机物与足量Na反应放出33.6LH2(气体体积均已折算为标准状况);
③分子中同一个碳原子上不连有相同的官能团.
(1)写出该有机物所含官能团的名称______、______.
(2)写出该有机物的结构简式______.
参考答案:该有机物与足量的NaHCO3反应放出CO2,说明该有机物含有羧基-COOH,-COOH与HCO3-按1:1反应,134g该有机物的物质的量为134g134g/mol=1mol,与足量的NaHCO3反应放出44.8LCO2,二氧化碳的物质的量为44.8L22.4L/mol=2mol,故该有机物分子中含有2个-COOH;等质量该有机物与足量Na反应放出33.6LH2(气体体积均已折算为标准状况),氢气的物质的量为33.6L22.4L/mol=1.5mol,2mol-COOH可以生成1mol氢气,所以该有机物还含有-OH,-OH与Na反应生成的氢气的物质的量为2mol-1mol=0.5mol,所以该有机物含有-OH数目为0.5mol×21mol=1,2个-COOH与1个-OH的总的式量为2×(12+32+1)+17=107,所以分子中剩余基团的总式量为134-107=27,由于有机物完全燃烧后只生成CO2和水,故该有机物只含有C、H、O三种元素,所以剩余基团为C2H3,分子中同一个碳原子上不连有相同的官能团,所以该有机物的结构简式为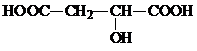 .
.
(1)由上述分析可知,该有机物所含官能团为羧基、羟基.
故答案为:羧基、羟基.
(2)由上述分析可知,该有机物的结构简式为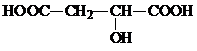 .
.
故答案为: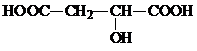 .
.
本题解析:
本题难度:一般
3、选择题 从樟科植物枝叶提取的精油中含有一种有机物: 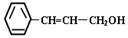 ?,则对该有机物的说法正确的是
?,则对该有机物的说法正确的是
A.能分别溶于水和CCl4
B.分子中所有原子在同一平面内
C.能使溴水、酸性高锰酸钾溶液褪色
D.能发生硝化反应、酯化反应、水解反应
参考答案:C
本题解析:A.有机物大多数不能溶解于水,而能溶解于有机物中。因此这种说法是错误的。B.在分子中含有苯环的平面结构、乙烯的平面结构和甲烷的四面体结构。苯环的平面结构与乙烯的平面结构共平面是可以的,但是饱和C原子上的原子则最多还有2个原子在该平面内。因此不可能分子中所有原子在同一平面内。错误。C.在该分子中含有碳碳双键和醇羟基,能溴水、酸性高锰酸钾溶液反应,因此能使二者褪色。正确。
本题难度:一般
4、推断题 有机玻璃在生活中随处可见,喹啉是抗结核药物。两物质的某种合成路线如下:

请回答下列问题:
(1)苯胺的分子式是:?。
(2)下列说法正确的是?(填序号)。
a.反应②是氧化反应;?
b.丙三醇、丙烯醛、A、B都可与金属钠反应放出氢气;
c.物质A、B、E都可与溴水发生加成反应而褪色;
d.有机玻璃可以发生水解反应。
(3)物质B属于?(填序号)。
a.烷烃? b.烯烃? c.醇? d.酸? e. 酯
(4)写出下列反应的化学方程式:
④?;
⑤?。
(5)反应⑥的产物为苯胺、FeCl2和?;在催化剂作用下,喹啉与氢气加成后的产物为(写结构简式)?。
参考答案:(16分)(化学方程式各3分,其他每空各2分)
(1)C6H7N?(2)a、c、d?(3)e?
(4)④
⑤
(5)H2O?
本题解析:(1)由结构简式推断,苯胺由2种原子团(C6H5-、-NH2)构成,则其分子式为C6H7N;(2)反应②是丙烯醛变为丙烯酸,属于氧化反应,故a正确;丙三醇、丙烯酸都能与Na反应放出氢气,它们分别含有羟基和羧基,而丙烯醛、丙烯酸甲酯都不能与Na反应,故b错误;A、B、E分子中均含有碳碳双键,碳碳双键都能与Br2发生加成反应,故c正确;有机玻璃中含有酯基,在一定条件下能发生水解反应,故d正确;(3)B是丙烯酸与甲醇在浓硫酸加热下发生酯化反应得到的有机产物,名称为丙烯酸甲酯,其结构简式为CH2=CHCOOCH3,属于不饱和酯,故只有e正确;(4)④是n摩尔丙烯酸甲酯在催化剂作用下发生的加聚反应,生成1摩尔聚丙烯酸甲酯;⑤是苯与浓硝酸在浓硫酸加热下发生的取代反应或硝化反应,生成硝基苯和水;(5)⑥的反应物是硝基苯、Fe、HCl,生成物是苯胺、FeCl2,根据氯、氢、氧等原子个数守恒推断,生成物还有H2O;由于苯和碳碳双键都能与氢气在一定条件下的加成反应,1mol苯最多与3molH2加成,1mol碳碳双键与1molH2加成,根据结构相似、性质相似推断,1mol喹啉最多与5molH2的环状有机物,所含官能团中的N—H键不能省略。
本题难度:困难
5、简答题 (化学--选修化学与技术)
海水中溶解了大量的气体物质和各种盐类.人类在陆地上发现的100多种元素,在海水中可以找到80多种.海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景.回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备,但由于使用大量燃煤,因此能耗多、排污量大.为克服蒸馏法海水淡化的缺陷,请你对蒸馏法淡化海水的工艺提出一条改进建议______.
(2)使用离子交换树脂与水中的离子进行交换也是常用的水处理技术.聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式______..
(3)空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液):
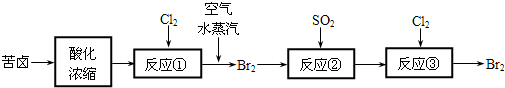
①反应②的离子方程式为______;?②从反应③后的四氯化碳溶液中分离出单质溴的方法是______.
(4)苦卤中含有NaCl、MgCl2、KCl、MgSO4.用简要的文字说明如何测定苦卤中MgCl2的含量______.
参考答案:(1)能代替大量燃煤能耗多、排污量大的缺陷的办法是寻找新的清洁能源,这是淡化海水工艺面临的问题,而潮汐能、风能、太阳能等均是海边富有的洁净能源,
故答案为:充分利用潮汐能、风能、太阳能等海边富有的洁净能源;
(2)聚丙烯酸钠是丙烯酸钠加聚反应的产物,根据聚合物找单体的方法,则单体为丙烯酸钠,结构简式为:CH2=CHCOONa,故答案为:CH2=CHCOONa;
(3)溴具有氧化性,能将具有还原性的二氧化硫氧化,反应为:SO2+Br2+2H2O=4H++2Br-+SO42-,两种互相溶解物质分离的方法叫蒸馏,故答案为:SO2+Br2+2H2O=4H++2Br-+SO42-;蒸馏;
(4)苦卤中含有MgCl2、MgSO4两种含镁离子的盐,测定苦卤中MgCl2的含量必须将硫酸镁中的镁离子去除,可以先用足量BaCl2溶液沉淀硫酸根离子,求出硫酸根离子的总量,并求出MgSO4的量,然后用足量NaOH溶液沉淀Mg2+,求出总的Mg2+,减去MgSO4中的Mg2+得到MgCl2的量,故答案为:先用足量BaCl2溶液沉淀硫酸根离子,求出硫酸根离子的总量,并求出MgSO4的量,然后用足量NaOH溶液沉淀Mg2+,求出总的Mg2+,减去MgSO4中的Mg2+得到MgCl2的量.
本题解析:
本题难度:一般