微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3H2OAl2O3+3H2↑电解过程中,以下判断正确的是:
?
| ?电池
| ?电解池
|
A
| H+移向Pb电极
| H+移向Pb电极
|
B
| 每消耗3molPb
| 生成2molAl2O3
|
C
| 正极:PbO2+4H++2e—=Pb2++2H2O
| 阳极:2Al+3H2O-6e—=Al2O3+6H+
|
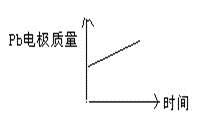
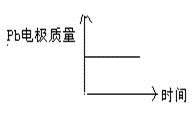
D
| 
| 
|
?
参考答案:D
本题解析:铅蓄电池负极为Pb,Pb-2e-+SO42-=PbSO4;
正极是PbO2,PbO2+2e-+SO42-+4H+=PbSO4+2H2O。
阴离子向负极移动,阳离子向正极移动;两极质量均增加。
电解池中,阳极Al,2Al+3H2O-6e-=Al2O3+6H+;
阴极Pb,6H++6e-=3H2;
每消耗3Pb,生成1mol Al2O3。答案选D。
本题难度:一般
2、简答题 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
(1)电极b上发生的电极反应为______.
(2)电极b上生成的气体在标状况下的体积为______,此时甲烧杯中NaOH溶液的物质的量浓度为(设溶液的密度为1g/cm3)______.
(3)电极c的质量变化是______g,欲使电解后乙中的电解液恢复到起始状态,应该向溶液中加入适量的______(填字母编号).
A.Cu(OH)2?B.Cu2O?C.CuCO3?D.Cu2(OH)2CO3
(4)其他条件不变,如果把乙装置改为电解精炼铜,则c电极的材料为______,d电极的材料为______.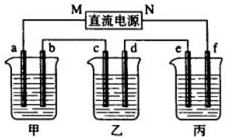
参考答案:(1)甲为5.51%的NaOH溶液,b为阳极,阳极上氢氧根离子放电生成氧气,电极方程式为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
(2)丙为200g10.00%的K2SO4溶液,通电时为电解水,其中m(K2SO4)=200g×10.00%=20g,
接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,设溶液的质量为m,则m×10.47%=20g,m=191g,电解水的质量为200g-191g=9g,n(H2O)=0.5mol,
由2H2O?通电?.?2H2↑+O2↑可知转移电子1mol电子,
电极b方程式为4OH--4e-=2H2O+O2↑,转移1mol电子,生成0.25molO2,体积为5.6L,
甲也为电解水的电解装置,应减少水9g,则电解后NaOH溶液的质量为109g-9g=100g,体积为0.1L,
又n(NaOH)=109g×5.51%40g/mol=0.15mol,
则c(NaOH)=0.15mol0.1L=1.5mol/L,
故答案为:5.6?L;1.5mol/L;
(3)电极c反应为Cu2++2e-=Cu,转移1mol电子生成0.5molCu,质量为32g,
电解硫酸铜溶液时阳极生成氧气,阴极生成铜,则欲使电解后乙中的电解液恢复到起始状态,应该向溶液中加入适量的CuO,
故答案为:32;?C;
(4)把乙装置改为电解精炼铜,阴极应为纯铜,阳极为粗铜,故答案为:精铜或纯铜;粗铜.
本题解析:
本题难度:一般
3、选择题 日常用的电池为锌锰干电池,其电极分别为碳棒和锌壳,以糊状NH4Cl作电解质(其中加入MnO2氧化吸收H2),电极反应式为:Zn-2e-═Zn2+;2NH4++2e-═2NH3+H2.根据叙述试判断下列说法中正确的是( )
A.锌锰干电池中Zn为正极,碳棒为负极
B.锌锰干电池工作时,电子由碳极经外电路流向Zn极
C.锌锰干电池长时间连续使用时内装糊状物会流出腐蚀电器
D.锌锰干电池能将化学能转化为电能和将电能转化为化学能
参考答案:A.锌失电子而作负极,碳棒为正极,故A错误;
B.干电池工作时,电子从锌电极经外电路流向正极碳棒,故B错误;
C.NH4Cl和ZnCl2都是强酸弱碱盐水解呈酸性,所以干电池长时间连续使用时内装糊状物可能流出腐蚀电器,故C正确;
D.原电池是把化学能转化为电能的装置,所以锌锰干电池能将化学能转化为电能,故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 如图所示装置,能够组成原电池且产生电流的是( )
A.

B.

C.
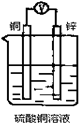
D.
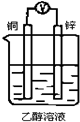
参考答案:A、两个电极材料相同,不能够组成原电池且产生电流,故A错误;
B、两个电极材料相同,不能够组成原电池且产生电流,故B错误;
C、符合原电池的构成条件,故C正确;
D、乙醇不是电解质溶液且不能自发的进行氧化还原反应,故D错误.
故选C.
本题解析:
本题难度:一般
5、选择题 表明金属甲比金属乙活动性强的叙述正确的是
A.在氧化还原反应中,甲失电子数比乙多
B.同价态阳离子;甲比乙氧化性强
C.常温下甲能与浓HNO3反应而乙不能
D.将甲、乙组成原电池时,甲为负极
参考答案:D
本题解析:
本题难度:困难