微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 “绿色化学”对化学反应提出了“原子经济性”(原子节约)的新概念及要求,理想原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放。下列反应类型一定符合这一要求的是
[? ]
①取代反应 ②加成反应 ③消去反应 ④水解反应 ⑤加聚反应 ⑥缩聚反应 ⑦酯化反应
A.①④
B.②③
C.⑤⑥
D.②⑤
参考答案:D
本题解析:
本题难度:简单
2、选择题 在绿色化学工艺中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%.在用CH3C═CH合成CH2═C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要的其他反应物有( )
A.CO2和H2O
B.CO和CH3OH
C.CH3OH和H2
D.H2和CO2
参考答案:由于在“绿色化学”工艺中,原子利用率为100%,故生成的产品CH2═C(CH3)COOCH3与原料之间元素种类和原子数目都完全相同,即原子守恒.将生成物中各原子个数减去反应物中各原子个数得到一些原子,无污染的反应途径和工艺是在始态实现污染预防,而非终端治理的科学手段.由于在通过化学转化获取新物质的过程中已充分利用了各种原料,因而生产过程和末端的差值为C2H4O2,对照选项,反应物中原子数之和为C2H4O2的只有B.
用CH3C═CH(丙炔)合成CH2═C(CH3)COOCH3(2-甲基丙烯酸甲酯),要把一个C3H4分子变成一个C5H8O2分子,还必须增加2个C原子、4个H原子、2个O原子,即原料中另外的物质中C、H、O的原子个数比为1:2:1.
A、CO2和H2O,两种物质分子里三种原子不论怎样组合也都不能使C、H、O的原子个数比为1:2:1,故A错误;
B、CO和CH3OH,两种物质如果按照分子个数比1:1组合,则C、H、O的原子个数比为1:2:1,故B正确;
C、CH3OH和H2,两种物质分子里三种原子不论怎样组合都不能使C、H、O的原子个数比为1:2:1,故C错误;
D、H2和CO2,,两种物质分子里三种原子不论怎样组合也都不能使C、H、O的原子个数比为1:2:1,故D错误;
故选B.
本题解析:
本题难度:一般
3、选择题 绿色化学的目标是
[? ]
A、减少对环境的污染
B、防患于未然,最终杜绝化学污染源
C、设计对人类健康和环境更安全的化合物
D、研究变换基本原料和起始化合物
参考答案:B
本题解析:
本题难度:简单
4、填空题 工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
?压强/MPa
转化率/%
温度/℃?
| 0.1
| 0.5
| 1
| 10
|
400
| 99.2
| 99.6
| 99.7
| 99.9
|
500
| 93.5
| 96.9
| 97.8
| 99.3
|
600
| 73.7
| 85.8
| 89.5
| 96.4
|
?
(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?________________________________________________________。
(2)在400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:__________________________________________。
(3)选择适宜的催化剂,是否可以提高SO2的转化率?________(填“是”或“否”),是否可以增大该反应放出的热量?________(填“是”或“否”)。
(4)为提高SO3吸收率,实际生产中用________吸收SO2。
(5)已知:2SO2(g)+O2(g)=2SO3(g) ΔH=-196.9 kJ·mol-1,计算每生产1万吨98%的硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
参考答案:(1)压强一定时,温度升高时,SO2转化率下降,说明升温有利逆反应的进行,所以正反应为放热反应
(2)增大压强对提高SO2转化率无显著影响,反而会增加成本
(3)否 ?否
(4)浓硫酸
(5)8.0×103 t 9.845×109 kJ
本题解析:(1)根据表格中的数据可以看出,在相同压强下(如在0.1 MPa下)升高温度(如由400℃升高到500℃)时SO2的转化率降低(由99.2%降低为93.5%),即升高温度时此化学平衡向逆反应方向移动,而升高温度化学平衡应该向吸热反应方向移动,所以此反应的正反应为放热反应。
(2)根据表格中的数据可以得知:在0.1MPa下SO2的转化率已经很高,如在400℃时已达99.2%,若增大压强到10 MPa,压强增大了100倍但是SO2的转化率增大为99.9%,只增大了0.7%,变化不大。而压强增大100倍,需要对设备的材料、动力、能源等都做相应地提高,增大成本投入。
(3)使用催化剂只能改变化学反应的速率,改变反应到达平衡的时间,不能使化学平衡发生移动,即对SO2的转化率不产生影响;而在一定条件下,化学反应放出的热量与参加反应的反应物的量成正比,因SO2的转化率不变,所以反应放出的热量也不会增大。
(4)在生产实际中是采用98.3%的浓硫酸作吸收剂来吸收SO3的。因为若用水进行吸收会形成酸雾,将影响SO3的吸收速率和效率。
(5)1万吨98%的硫酸含H2SO4的质量:9.8×109 g。
设需要SO3的质量为x,该反应产生的热量为y。
H2SO4~ SO3~ 放出的热量
98 g?80 g?196.9 kJ×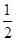
9.8×109 g? x?y
则 =
=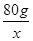 =
=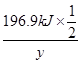 ,
,
解得x=8.0×103 t,y=9.845×109 kJ。
本题难度:一般
5、选择题 下列有关工业生产的叙述正确的是(?)
A.合成氨生产过程中将NH3液化分离,可提高N2、H2的转化率
B.硫酸工业中,为了提高SO2的转化率,用五氧化二钒作催化剂,
C.电解饱和食盐水制烧碱采用离子交换膜法,可防阴极室产生的C12进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量和阴极析出铜的质量相同
参考答案:A
本题解析:略
本题难度:一般