|
高考化学知识点归纳《热化学方程式》考点巩固(2017年最新版)(八)
2017-09-23 23:54:31
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知在298K时的有关数据:C(s)+1/2O2(g)===CO(g);ΔH1=-110.5kJ·mol-1;
C(s)+O2(g)===CO2(g);ΔH2=-393.5kJ·mol-1。则C(s)+CO2(g)===2CO(g)的ΔH为( )
A.+283.5kJ·mol-1
B.+172.5kJ·mol-1
C.-172.5kJ·mol-1
D.-504kJ·mol-1
|
参考答案:B
本题解析:根据盖斯定律可知,①×2-②即得到C(s)+CO2(g)===2CO(g),所以该反应的ΔH=-110.5kJ/mol×2+393.5kJ/mol=+172.5kJ·mol,答案选B。
考点:考查反应热的计算
点评:该题是高考中的常见题型,属于基础性试题的考查。该题的关键是利用好盖斯定律,然后结合题意灵活运用即可。
本题难度:一般
2、填空题 氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。
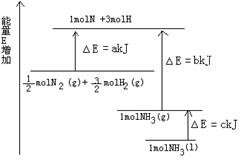
(1)如图是N2与H2反应过程中能量变化的示意图,则该反应生成液态氨的热化学方程式是 。
(2)已知:①H2O(g)=H2O(l) ΔH=-Q1 kJ·mol-1
②C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-Q2 kJ/mol ③C2H5OH(g)=C2H5OH(l) ΔH=-Q3 kJ/mol
则23 g液体酒精完全燃烧生成CO2(g)和H2O(l),释放出的热量为 kJ(请用Q1、Q2、Q3来表示 )
参考答案:(1)N2(g) +3H2(g)  2NH3(l) △H=" -2(b+c-a)" kJ/mol(2)(0.5Q2+1.5Q1-Q3) 2NH3(l) △H=" -2(b+c-a)" kJ/mol(2)(0.5Q2+1.5Q1-Q3)
本题解析:(1)根据图示可知:由反应物的能量与生成物的能量的关系可知N2与H2反应生成液态氨的热化学方程式是N2(g) +3H2(g)  2NH3(l) △H=" -2(b+c-a)" kJ/mol。(2)②-③+3×①整理可得C2H5OH(g)+ 3O2(g)=2CO2(g)+3H2O(l) △H=-(Q2+3Q1-Q3) kJ/mol。1mol的乙醇质量为46g.所以23 g液体酒精即0.5mol完全燃烧生成CO2(g)和H2O(l),释放出的热量为(0.5Q2+1.5Q1-Q3)KJ. 2NH3(l) △H=" -2(b+c-a)" kJ/mol。(2)②-③+3×①整理可得C2H5OH(g)+ 3O2(g)=2CO2(g)+3H2O(l) △H=-(Q2+3Q1-Q3) kJ/mol。1mol的乙醇质量为46g.所以23 g液体酒精即0.5mol完全燃烧生成CO2(g)和H2O(l),释放出的热量为(0.5Q2+1.5Q1-Q3)KJ.
考点:考查热化学方程式的书写及反应热的计算的知识。
本题难度:一般
3、填空题 写出下列反应的热化学方程式.
(1)4g硫粉完全燃烧生成二氧化硫气体,放出37kJ的热量.
______
(2)9g铝与足量氯气化合生成固体氯化铝,放出热量274.2kJ.
______.
参考答案:(1)4g硫粉完全燃烧生成二氧化硫气体,放出37kJ的热量,所以32g硫粉完全燃烧生成二氧化硫气体,放出296kJ的热量,则热化学方程式为:S(s)+O2(g) ═SO2(g) △H=-296KJ/mol,
故答案为:S(s)+O2(g)═SO2(g)△H=-296KJ/mol;
(2)9g铝与足量氯气化合生成固体氯化铝,放出热量274.2kJ,所以54g铝与足量氯气化合生成固体氯化铝,放出热量1645.2KJ,则热化学方程式:2Al(s)+3Cl2(g) ═2AlCl3(s)△H=-1645.2KJ/mol,
故答案为:2Al(s)+3Cl2(g)═2AlCl3(s)△H=-1645.2KJ/mol.
本题解析:
本题难度:一般
4、选择题 灰锡(常温下以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s,白)+2HCl(aq)== SnCl2(aq)+H2(g) ΔH1
②Sn(s,灰)+2HCl(aq)== SnCl2(aq)+H2(g) ΔH2
③Sn(s,灰)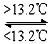 Sn(s,白) ΔH3 = +2.1 kJ·mol-1 Sn(s,白) ΔH3 = +2.1 kJ·mol-1
下列说法正确的是
[? ]
A.ΔH1>ΔH2
B.锡在常温下以白锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2 ℃的环境中,会自行毁坏
参考答案:BD
本题解析:
本题难度:一般
5、填空题 已知下列三个热化学方程式
①H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8?kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH=-393.5?kJ·mol-1
③C(s)+H2O(g)===CO(g)+H2(g)?ΔH=+131?kJ·mol-1
写出表示碳燃烧生成CO和CO燃烧生成CO2的燃烧热的热化学方程式。
_________________________________________;
_________________________________________。
参考答案:C(s)+1/2O2(g)===CO(g)?ΔH=-110.8?kJ·mol-1
CO(g)+1/2O2(g)===CO2(g)?ΔH=-282.7?kJ·mol-1
本题解析:
本题难度:一般
|