微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能。工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H 1=" -" 90.7 kJ·mol-1
CH3OH(g) △H 1=" -" 90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2 =" -" 23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2 =" -" 23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3 =" -" 41.2 kJ·mol-1
CO2(g)+H2(g) △H3 =" -" 41.2 kJ·mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)。
CH3OCH3(g)+CO2(g)。
该反应的反应热△H =_________。催化反应室中采用300℃的反应温度,理由是 。
(2)已知:反应①在300℃时的化学平衡常数为0.27。该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将(填“正向进行”、“逆向进行”或“处于平衡状态”)。
(3)上述流程中二甲醚精制的实验操作名称为 。
(4)图为绿色电“二甲醚燃料电池”的工作原理示意图。
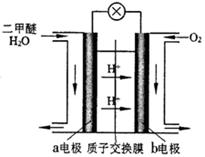
该电池工作时,H+向 极移动(填“正”或“负”);a电极的电极反应式为 。
参考答案:(1)-246.1KJ/mol,提高化学反应速率;(2)逆向进行;
(3)蒸馏;(4)正,CH3OCH3-12e-+3H2O=2CO2+12H+
本题解析:(1)①×2+②+③,整理可得3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
△H=2△H 1+△H2 +△H3 =-246.1KJ/mol;由于该反应的正反应是放热反应,所以若要采用很高的温度,反应物的转化率 降低,之所以在催化反应室中采用300℃的反应温度,是为了提高化学反应速率,缩短达到平衡所需要的时间;(2)各种物质的浓度分别是:c(CO)=1mol/L; c(H2)="1.5mol/L;" c(CH3OH)=1mol/L.由于Q=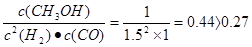 ,所以此时反应将逆向进行;(3)在上述反应过程中制取的物质中除了含有二甲醚外,还含有甲醇、CO、CO2、水蒸气,所以制取流程中二甲醚精制的实验操作名称为蒸馏;(4)在绿色电“二甲醚燃料电池”工作时,H+向负电荷较多的正极极移动;负极a电极的电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+。
,所以此时反应将逆向进行;(3)在上述反应过程中制取的物质中除了含有二甲醚外,还含有甲醇、CO、CO2、水蒸气,所以制取流程中二甲醚精制的实验操作名称为蒸馏;(4)在绿色电“二甲醚燃料电池”工作时,H+向负电荷较多的正极极移动;负极a电极的电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+。
考点:考查盖斯定律的应用、反应热效应的判断、化学反应进行的方向的判断、混合物的分离方法、燃料电池 的电极反应式的书写的知识。
本题难度:困难
2、选择题 下列有关化学电源的叙述,正确的是
[? ]
A.化学电源比火力发电对化学能的利用率高
B.化学电源所提供的电能居于人类社会现阶段总耗电量的首位
C.化学电源均是安全、无污染的
D.化学电源即为可充电电池
参考答案:A
本题解析:
本题难度:简单
3、选择题 燃料电池是燃料(如CO、H2、CH4等)跟O2(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如KOH)溶液,下列关于甲烷燃料电池的说法中不正确的是( )
A.通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应
B.负极的电极反应式为CH4+10OH--8e-═CO
+7H2O
C.随着不断放电,电解质溶液的pH保持不变
D.甲烷燃料电池的能量利用率比甲烷燃烧的大
参考答案:A、通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应,故A正确;
B、正极反应为O2+2H2O+4e-=4OH-;总化学方程式为:CH4+2O2+2OH-=CO32-+3H2O;总反应减去正极反应得到负极的电极反应式为:CH4+10OH--8e-═CO?2-3+7H2O;故B正确;
C、随着不断放电,原电池反应中反应生成水,氢氧根离子浓度减小,电解质溶液的pH减小,故C错误;
D、甲烷燃料电池实现化学能转化为电能,电池反应的能量利用率比甲烷燃烧的大,故D正确;
故选C.
本题解析:
本题难度:简单
4、选择题 下列化学电池中,不易造成环境污染的是
[? ]
A.氢氧燃料电池
B.锌锰电池
C.镍镉电池
D.铅蓄电池
参考答案:A
本题解析:
本题难度:简单
5、实验题  是银锌碱性电池的正极活性物质,可通过下列方法制备:在
是银锌碱性电池的正极活性物质,可通过下列方法制备:在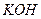 加入适量
加入适量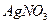 ?溶液,生成
?溶液,生成 沉淀,保持反应温度为80,边搅拌边将一定量
沉淀,保持反应温度为80,边搅拌边将一定量 溶液缓慢加到上述混合物中,反应完全后,过滤、洗剂、真空干燥得到固体样品。反应方程式为
溶液缓慢加到上述混合物中,反应完全后,过滤、洗剂、真空干燥得到固体样品。反应方程式为

回答下列问题:
(1)上述制备过程中,检验洗剂是否完全的方法是?.
(2)银锌碱性电池的电解质溶液为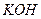 溶液,电池放电时正极的
溶液,电池放电时正极的 ?转化为
?转化为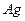 ,负极的
,负极的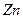 转化为
转化为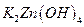 ,写出该电池反应方程式:?.
,写出该电池反应方程式:?.
(3)准确称取上述制备的样品(设 仅含和
仅含和 )2.558g,在一定的条件下完全分解为
)2.558g,在一定的条件下完全分解为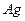 ?和
?和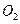 ?,得到224.0mL
?,得到224.0mL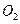 (标准状况下)。计算样品中
(标准状况下)。计算样品中 的质量分数(计算结果精确到小数点后两位)。
的质量分数(计算结果精确到小数点后两位)。
参考答案:(1)取少许最后一次洗涤滤液,滴入1~2滴Ba(NO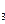 )
)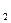 溶液,若不出现白色浑浊,表示已洗涤完全(取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全)
溶液,若不出现白色浑浊,表示已洗涤完全(取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全)
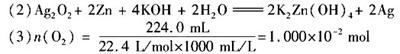
设样品中Ag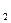 O
O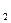 的物质的量为x,Ag
的物质的量为x,Ag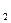 O 的物质的量量为y
O 的物质的量量为y
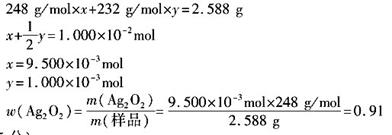
本题解析:略
本题难度:一般