| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《离子共存》试题特训(2017年最新版)(二)
参考答案:C 本题解析:A、HCO3-与 NH4+和Al3+能发生双水解不能大量共存。故错 本题难度:简单 3、选择题 某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中 |
参考答案:D
本题解析:取溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,说明含有NH4+,其物质的量是:n(NH4+)=0.02mol;同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;说明含有Fe3+,根据元素守恒可得:n(Fe3+)=2n(Fe2O3)=(1.6g÷160g/mol)×2=0.02mol;由于Fe3+与CO32-会发生离子反应而不能大量共存,所以一定不含有CO32-;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀,则说明含有SO42-,其物质的量是:n(SO42-)=4.66g÷233g/mol=0.02mol。溶液呈电中性。已经确定的离子中,阳离子带的正电荷总数是:3n(Fe3+)+ n(NH4+)=3×0.02mol+0.02mol=0.08mol,SO42-带有的负电荷总数是2n(SO42-)=2×0.02mol=0.04mol<0.08mol,说明还应该含有阴离子Cl-,若溶液中无其它阳离子,则c(Cl-)="(0.08mol-0.04mol)" ÷0.1L=0.4mol/L;若还含有其它阳离子,则由于正电荷总数增加,所以Cl-的浓度也增大,因此c(Cl-)≥0.4mol/L,故选项是D。
考点:考查溶液成分的确定的知识。
本题难度:困难
4、选择题 下列各组离子在相应的条件下可以大量共存的是( )
A.在碱性溶液中:CO32-、K+、Cl-、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42-
C.在c(H+)/c(OH-)═1×10-12的溶液中:NH4+、Ca2+、Cl-、K+
D.在中性溶液中:Fe3+、Na+、SCN-、Cl-
参考答案:A、在碱性溶液中,能和氢氧根反应的离子不共存,CO32-、K+、C1-、Na+和氢氧根离子均不反应,故A正确;
B、与铝粉反应放出氢气的无色溶液可以是强酸性溶液,还可以是强碱性溶液,碱性时,镁离子不能共存,酸性时,硝酸根离子不能共存,因为硝酸和金属铝反应会生成一氧化氮,不是氢气,故B错误;
C、c(H+)/c(OH-)═1×10-12的溶液中,氢氧根的浓度是0.1mol/L,溶液为碱性环境,铵根离子不能共存,故C错误;
D、Fe3+、SCN-会发生络合反应,不能共存,故D错误.
故选A.
本题解析:
本题难度:一般
5、填空题 某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。
依据实验回答下列问题:
(1)由①可知存在的离子为?,浓度是?mol·L-1。
由②可知存在的离子为?,浓度是?mol·L-1。
由③可知存在的离子为?,浓度是?mol·L-1。
(2)该溶液中一定不存在的离子是?(填离子符号)。
(3)某同学通过分析认为该溶液中一定存在K+,他的理由是?。
参考答案:(共10分)(1)NH4+? 0.2;Al3+? 0.2 ; SO42-? 0.5 (每空1分,共6分)
(2)Fe3+、Mg2+、Ba2+、CO32-(2分)
(3)已知的NH4+、Al3+的正电荷总量小于SO42-负电荷总量 ,依据电荷守恒,一定有K+存在(2分)
本题解析:(1)第一份加过量NaOH溶液后加热,收集到0.02mol气体,这说明生成的气体一定是氨气,物质的量是0.02mol,因此移一定含有NH4+。根据原则守恒可知,浓度NH4+是0.02mol÷0.1L=0.2mol/L。无沉淀生成,同时得到溶液甲,这说明一定没有Fe3+、Mg2+。向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体。因此该白色沉淀只能是氢氧化铝,即甲溶液中中含有偏铝酸钠,所以原溶液中含有Al3+,有Al3+,就一定没有CO32-。根据原则守恒可知,Al3+浓度是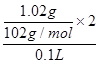 =0.2mol/L。第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。这说明该白色沉淀一定是硫酸钡,所以一定含有SO42-,则就一定没有Ba2+。根据原子守恒可知,SO42-的浓度是
=0.2mol/L。第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。这说明该白色沉淀一定是硫酸钡,所以一定含有SO42-,则就一定没有Ba2+。根据原子守恒可知,SO42-的浓度是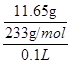 =0.5mol/L。
=0.5mol/L。
(2)该溶液中一定不存在的离子是Fe3+、Mg2+、Ba2+、CO32-。
(3)已知的NH4+、Al3+的正电荷总量小于SO42-负电荷总量,所以依据电荷守恒,一定有K+存在。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《绿色化学》.. | |