微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
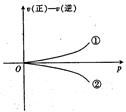
1、选择题 可逆反应在一定条件下达到平衡后,速率差值[即v(正)—v(逆)]与压强的变化曲线如右图所示,其中与曲线①相符的反应为(?)
A.2SO3(g)  2SO2(g)+02(g)
2SO2(g)+02(g)
B.H2(g)+I2(g)  2HI(g)
2HI(g)
C.C(s)+H2O(g)  C0(g)+H2(g)
C0(g)+H2(g)
D.N2(g)+3H2(g)  2NH3(g)
2NH3(g)
参考答案:D
本题解析:该图为可逆反应在一定条件下达到平衡后,速率差值[即v(正)—v(逆)]与压强的变化曲线图,由图可以看出压强越大,速率差越大,即v(正)—v(逆)越大,故增大压强,平衡向正反应方向移动,因为增大压强,反应2SO3(g)  2SO2(g)+02(g)向逆反应方向移动,故A错误;因为增大压强,反应 H2(g)+I2(g)
2SO2(g)+02(g)向逆反应方向移动,故A错误;因为增大压强,反应 H2(g)+I2(g)  2HI(g)不发生移动,故B错误;因为增大压强,反应 C(s)+H2O(g)
2HI(g)不发生移动,故B错误;因为增大压强,反应 C(s)+H2O(g)  C0(g)+H2(g) 向逆反应方向移动公司,故A错误;增大压强,反应N2(g)+3H2(g)
C0(g)+H2(g) 向逆反应方向移动公司,故A错误;增大压强,反应N2(g)+3H2(g)  2NH3(g)向正反应方向移动,故D符合题意,为本题的正确答案。
2NH3(g)向正反应方向移动,故D符合题意,为本题的正确答案。
点评:本题考查了化学平衡的移动方向,该题的出题形式比较新颖,解答该题的关键是要得到压强越大,速率差越大,即v(正)—v(逆)越大,故增大压强,平衡向正反应方向移动,然后对选项进行分析,该题难度中等。
本题难度:一般
2、选择题 对于反应2A(g) + xB(g)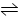 4C(g)达到平衡时 C的浓度为1.2 mol·L-1,当其它条件不变,把体积扩大1倍时,测得C的浓度为0.7 mol·L-1,则x的值为?(?)
4C(g)达到平衡时 C的浓度为1.2 mol·L-1,当其它条件不变,把体积扩大1倍时,测得C的浓度为0.7 mol·L-1,则x的值为?(?)
A 1? B 2? C 3? D 4
参考答案:A
本题解析:体积扩大1倍时,假设平衡不移动,C的浓度为0.6 mol·L-1,但测得C的浓度为0.7 mol·L-1,说明平衡右移,减小压强,平衡向气体体积增大的方向移动,所以,2+X<4,X<2,故选A。
本题难度:简单
3、选择题 在三个2L恒容的容器中,分别发生反应A(g)+3B(g) 2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4mol。
2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4mol。
?
| 反应前各物质的物质的量/mol
|
A
| B
| C
|
甲
| 1
| 3
| 0
|
乙
| 0
| 0
| 2
|
丙
| 1.5
| 4.5
| 1
|
下列说法正确的是(?)
A.乙中5min内C的反应速率为0.12mol/(L·min)
B.达到平衡时,丙中A的浓度是甲中的2倍
C.丙中反应的平衡常数大于甲中反应的平衡常数
D.达到平衡时,甲乙两容器中C的物质的量百分含量相等
参考答案:D
本题解析:乙容器相当于是1molA和3molB,所以甲和乙是等效的,D正确。平衡时甲容器中A的物质的量为0.4mol,则乙容器中,消耗C是0.8mol,所以C的反应速率是0.8mol÷2L÷5min=0.08mol/(L·min),A不正确。丙容器相当于2molA和6molB,由于正反应是体积减小的可逆反应,所以平衡时丙中A的浓度小于甲中的2倍,B不正确。平衡常数和温度有关系,所以丙和甲中平衡常数是相同的,C不正确。答案选D。
本题难度:一般
4、选择题 在一固定容积的密闭容器中,充入2molA和1molB发生反应:2A(g)+B(g)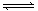 x C(g),达到平衡后,达到平衡时,C的物质的量浓度为0.9mol/L。若维持容器体积和温度不变,按0.6 molA, 0.3molB和1.4 molC为起始物质,达到平衡后,C的物质的量浓度也为0.9mol/L,则x的值为(?)
x C(g),达到平衡后,达到平衡时,C的物质的量浓度为0.9mol/L。若维持容器体积和温度不变,按0.6 molA, 0.3molB和1.4 molC为起始物质,达到平衡后,C的物质的量浓度也为0.9mol/L,则x的值为(?)
A.只能为2
B.只能为3
C.只能为4
D.可能为2或3
参考答案:D
本题解析:
正确答案:D
分两种情况分析:
1.当反应前后气体体积不相等,则两种投料方式换算到同一边后各组分应完全相同(即恒温恒容时一般可逆反应的等效平衡换算):
2A(g)?+? B(g) ?xC(g)
?xC(g)
起始量/mol:? 2?1? 0
等效于/mol:? 0.6?0.3? 1.4
等效于/mol: ?0.6+1.4*(2/x)? 0.3+1.4*(1/x) ?0
0.6+1.4*(2/x)?=2 ,? 0.3+1.4*(1/x)?=1,得x=2
2.当反应前后气体体积不变(即x=3),等效平衡只需要两种投料方式换算到同一边后各组分比例相同即可(恒温恒容时分子总数不变的可逆反应的等效平衡换算)。而1.4molC换算到反应物后,A与B的物质的量之比为2:1 ,与起始量的投料比相同,故x=3成立。
本题难度:一般
5、选择题 在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g) + nB(g) pC(g) + qD(g),当m、n、p、q为任意整数(不为零)时,能说明达到平衡状态的标志是(?)
pC(g) + qD(g),当m、n、p、q为任意整数(不为零)时,能说明达到平衡状态的标志是(?)
A.体系的压强不再改变
B.混合气体的密度不再改变
C.反应速率νA : νB : νC : νD =" m" : n : p : q
D.单位时间内m mol A断键发生反应,同时p mol C也断键发生反应
参考答案:D
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。D中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。由于不能确定反应前后反应前后气体体积的变化,所以选项A不一定正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,B不正确;速率之比是相应的化学计量数之比,因此C中的关系始终是成立,不正确,答案选D。
点评:判断化学平衡状态的标志有:(1)任何情况下均可作为标志的:①υ正=υ逆(同一种物质);②各组分含量(百分含量、物质的量、质量)不随时间变化;③某反应物的消耗(生成)速率、某生成物的消耗(生成)速率=化学计量数之比;(2)在一定条件下可作为标志的是:①对于有色物质参加或生成的可逆反应体系,颜色不再变化;②对于有气态物质参加或生成的可逆反应体系,若反应前后气体的系数和相等,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容);③对于恒温绝热体系,体系的温度不在变化;(3)不能作为判断标志的是:①各物质的物质的量或浓度变化或反应速率之比=化学计量数之比 (任何情况下均适用);②有气态物质参加或生成的反应,若反应前后气体的系数和相等,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容)。据此可以进行有关判断。
本题难度:一般