微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 过硼酸钠是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中.以硼砂(主要成为Na2B4O7)为原料生产过硼酸钠晶体的主要流程如下:

(1)由Na2B4O7和NaOH反应制NaBO2的离子方程式为______;
(2)沉淀A中含有酸不溶物和氢氧化镁杂质,为了分离出氢氧化镁,在沉淀中加过量的酸,过滤得到含Mg2+的滤液,再在滤液加入碱使Mg2+形成氢氧化镁.若加碱前溶液中c(Mg2+)=0.056mol?L-1,那么需调节溶液的pH=______时,才开始出现沉淀.[已知25℃下Mg(OH)2的Ksp=5.6×10-12]
(3)已知纯品过硼酸钠晶体中各元素的物质的量比为:n(Na):n(B):n(H):n(O)=1:1:n:7.将制得的纯品样品在
70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如右图所示,则T3时所得晶体的化学式为______.(书写简单计算过程)

(4)若反应温度控制不当,所得的过硼酸钠晶体中将混有NaBO2,则产品中钠的质量分数______(填“升高”、“降低”或“不变”).
2、实验题 (13分)工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32—(aq) PbCO3(s)+SO42—(aq)。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
PbCO3(s)+SO42—(aq)。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
(1)上述反应的平衡常数表达式:K=?。
(2)室温时,向两份相同的样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在?溶液中PbSO4转化率较大,理由是?。
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],它和PbCO3受热都易分解生成PbO。该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,请你完成假设二和假设三:
假设一:全部为PbCO3;
假设二:?;
假设三:?。
(4)为验证假设一是否成立,课题组进行如下研究。
①定性研究:请你完成下表中内容。
实验步骤(不要求写出具体操作过程)
| 预期的实验现象和结论
|
取一定量样品充分干燥,……
| ?
|
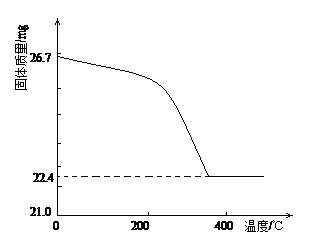
②定量研究:取26.7mg的干燥样品,加热,测的固体质量随温度的变化关系如下图。某同学由图中信息得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:?
?。
3、简答题 (16分)某煤渣主要含有Al2O3、SiO2,可制备碱式硫酸铝[Al2(SO4)3·2Al(OH)3]溶液,用于烟气脱硫,减少SO2的排放,其制备流程:
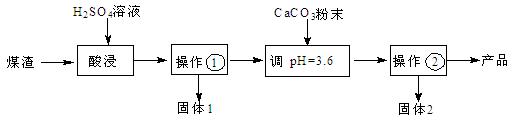
已知:25℃,Ksp(CaCO3)=2.8×10-9, Ksp(CaSO4)=9.1×10-6。
(1)操作①的名称 。
(2)酸浸时反应的离子方程式为 ;为了提高酸浸时铝元素的浸出率,可采取的措施____________________,___________________(写2条)。
(3)固体2的化学式是 ,试分析固体2生成的主要原因(用离子方程式结合文字简要说明) 。
(4)碱式硫酸铝溶液吸收SO2生成Al2(SO4)3·Al2(SO3)3,再向该溶液通入足量空气,生成一种硫酸盐,用于制备碱式硫酸铝溶液的循环使用,试写出有关反应的化学方程式: , 。
4、选择题 难溶物质在水中达到溶解平衡的溶度积常数与水的电离平衡常数相似。则关于BaSO4溶解平衡: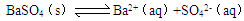 的下列说法正确的是(?)
的下列说法正确的是(?)
A.溶液的温度升高,BaSO4的溶度积常数不变
B.在Na2SO4溶液中,BaSO4的溶解度不变
C.在BaCl2溶液中,BaSO4的溶度积常数变小
D.精制NaCl时,在溶液中加入稍过量的BaCl2溶液是为了更好地除去SO42-等离子
5、选择题 在溶液中有浓度均为0.01mol·L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:
Ksp[Fe(OH)3] =2.6×10-39;?Ksp[Cr(OH)3] =7.0×10-31;
Ksp[Zn(OH)2] =1.0×10-17;?Ksp[Mg(OH)2] =1.8×10-11;
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小
A.Fe3+
B.Zn2+
C.Cr3+
D.Mg2+