微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 磷在氧气中燃烧,可能生成两种固态氧化物.3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出XkJ热量.
(1)通过计算确定反应产物的组成(用化学式表示)是______,其相应质量(g)为______.
(2)已知单质磷的燃烧热为YkJ/mol,则1mol?P与O2反应生成固态P2O3的反应热△H=______.
(3)写出1molP与O2反应生成固态P2O3的热化学方程式:______.
参考答案:(1)3.1g的单质磷(P)的物质的量为3.1g31g/mol=0.1mol,3.2g的氧气的物质的量为3.2g32g/mol=0.1mol,故P原子与O原子的数目之比为0.1mol:0.1mol×2=1:2,2:5<1:2<2:3,故反应产物为P2O3、P2O5,令物质的量分别为xmol、ymol,则:
本题解析:
本题难度:一般
2、填空题 2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
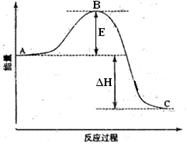
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中C表示 ;该反应通常用V2O5作催化剂,加V2O5会使图中B点降低,理由是 ;
(2)图中△H= kJ·mol-1;
(3)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1;
(4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H= 。
参考答案:(1)生成物总能量;催化剂能降低反应所需要的能量,提高活化分子百分数
(2)-198 (3)0.025 (4)-1185kJ/mol
本题解析:(1)图中A表示反应物总能量,C表示生成物总能量。E为活化能,使用催化剂,活化能降低,活化分子数增加,活化分子百分数增加。
(2)1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1,所以2SO2(g)+O2(g)  2SO3(g) ΔH=-198kJ·mol-1。
2SO3(g) ΔH=-198kJ·mol-1。
(3)化学反应速率比等于化学计量数比。
(4)由硫的燃烧热可写出热化学方程式:S(g)+O2(g)=SO2(g) ΔH=-296kJ·mol-1,由2SO2(g)+O2(g)  2SO3(g) ΔH=-198kJ·mol-1利用盖斯定律得S(g)+O2(g)=SO3(g) ΔH=-395kJ·mol-1,所以生成3 molSO3(g)的△H=-1185kJ/mol。
2SO3(g) ΔH=-198kJ·mol-1利用盖斯定律得S(g)+O2(g)=SO3(g) ΔH=-395kJ·mol-1,所以生成3 molSO3(g)的△H=-1185kJ/mol。
考点:化学反应与能量 活化能 热化学方程式 盖斯定律
点评:热化学方程中化学计量数表示物质的量。
本题难度:一般
3、选择题 甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5KJ热量,则下列热化学方程式中正确的是
[? ]
A.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH == +890 kJ·mol-1
B.CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH == +890 kJ·mol-1
C.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH == -1680 kJ·mol-1
D.CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH == -890 kJ·mol-1
参考答案:D
本题解析:
本题难度:简单
4、选择题 肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ/mol,N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)ΔH=-542.7 kJ/mol
B.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)ΔH=-1059.3 kJ/mol
C.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)ΔH=-1076.7 kJ/mol
D.N2H4(g)+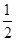 N2O4(g)===
N2O4(g)===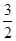 N2(g)+2H2O(g)ΔH=-1076.7 kJ/mol
N2(g)+2H2O(g)ΔH=-1076.7 kJ/mol