|
高考化学必考知识点《物质的量》考点特训(2017年冲刺版)(四)
2017-09-24 00:12:08
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 若以ω1和ω2分别表示浓度为a mol/L和b mol/L氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)
A.2ω1 = ω2
B.2ω2 = ω1
C.ω2
|
参考答案:
本题解析:
本题难度:困难
2、选择题 某氮的氧化物中,氮元素和氧元素的质量之比为7:20,此氧化物的化学式为( )
A.NO
B.NO2
C.N2O4
D.N2O5?
参考答案:D
本题解析:
本题难度:简单
3、选择题 下图是某品牌饮用矿泉水的标签的部分内容.下列说法正确的是( )
饮用矿物质水
净含量:500mL?配料表:纯净水?硫酸镁?氯化钾?保质期:12个月
主要离子成份:钾离子(K+):1.0~27.3mg/L?镁离子(Mg2+):0.1~4.8mg/L
氯离子(?Cl-):10~27.3mg/L?硫酸根离子(SO42-):0.4~19.2mg/L
|
A.标签上给出的离子的物理量是离子的物质的量浓度
B.任何饮用水中氯离子(Cl-)的浓度均在10~27.3mg/L
C.该品牌饮用矿泉水中c?Cl-)最大值为10~27.3mg/L之内
D.一瓶该品牌饮用矿泉水中SO42-的物质的挝不超过1×10-5mol
参考答案:A、该品牌饮用矿物质水中离子浓度表示单位体积内含有离子的质量,故A错误;
B、该品牌饮用矿物质水中氯离子10~27.3mg/L,不能说明其它饮用水中氯离子浓度均在10~27.3mg/L之间,故B错误;
C、氯离子(?Cl-1):10~27.3mg/L,该品牌饮用矿泉水中c(Cl-)最大值为10~27.3mg/L之内,故C正确;
D、硫酸根离子(SO42-):0.4~19.2mg/L,1瓶该品牌饮用矿泉水的体积为500mL,硫酸根离子的质量最大值为19.2mg/L×0.5L=9.6mg,故n(SO42-)的最大值为0.0096g96g/mol=1×10-4mol,硫酸根离子的质量最大值为19.2mg/L×0.5L=9.6mg,故n(SO42-)的最大值为0.0096g96g/mol=1×10-4mol,故D错误;
故选C.
本题解析:
本题难度:一般
4、简答题 某实验需要80mL、1mol/L的Na2CO3溶液,现通过如下操作配制:
①称量?g?Na2CO3固体放入小烧杯中,加适量蒸馏水溶解.为加快溶解可以使用?玻璃棒搅拌
②待溶液冷却到室温后,小心转入?(填仪器名称)
③继续加蒸馏水至液面至刻度线1~2cm处,改用?(填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切
④将容量瓶塞紧,充分摇匀.
⑤用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都转入容量瓶,并轻轻摇匀
(1)操作步骤正确的顺序是?(填序号).
(2)使用容量瓶前必须进行的一项操作是?
(3)若所配溶液的密度为1.06g/mL,则该溶液的质量分数为?.
(4)若取出20mL配好Na2CO3的溶液,加蒸馏水稀释成c(Na+)=0.1mol/L的溶液,则稀释后溶液的体积为?mL
(5)在配制Na2CO3溶液时,下列操作中的?会导致结果偏低
①用拖盘天平称量时砝码放在左盘
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
③定容时俯视刻度线
④未冷却到室温就转移到容量瓶中
⑤干净的容量瓶未经干燥就用于配制溶液.
参考答案:没有80mL的容量瓶,所以应选择100mL容量瓶.即所配溶液体积为100mL,
所以需Na2CO3的质量为m=0.1L×1mol?L-1×106g/mol=10.6g.
(1)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以需要的仪器有天平、烧杯、玻璃棒、100mL容量瓶、胶头滴管、药匙.
正确的操作顺序是①②⑤③④.
故答案为:10.6?g;玻璃棒;100ml容量瓶;?胶头滴管;(1)①②⑤③④;
(2)定容后需颠倒摇匀,使用容量瓶前必须进行检查容量瓶是否漏水,故答案为:查漏;
(3)根据c=1000ρωM可知,碳酸钠溶液的质量分数ω=cM1000ρ=1×1061000×1.06=10%,故答案为:10%;
(4)所配溶液c(Na+)=2c(Na2CO3)=2×1mol?L-1=2mol?L-1,
根据稀释定律,稀释前后溶质的物质的量不变,来计算稀释后碳酸钠溶液的体积.
设稀释后碳酸钠溶液的体积为xmL,所以20mL×2mol/L=xmL×0.1mol/L,解得:x=400,所以稀释后碳酸钠溶液的体积是400mL.
故答案为:400mL;
(5)①称量碳酸钠固体时,砝码和物质的位置对调,如未使用游码,对碳酸钠的质量无影响,对所配溶液浓度无影响;
若使用游码,碳酸钠的实际质量减小,所配溶液的浓度偏低.本题碳酸钠质量为10.6?g,使用游码,所配溶液浓度偏低;②向容量瓶中转移溶液时,有溶液洒落在容量瓶外,转移到容量瓶中碳酸钠的质量减小,所配溶液浓度偏低;
③定容时,俯视容量瓶刻度线,使溶液的体积偏低,所以溶液浓度偏高;
④碳酸钠溶解放热,未冷至室温即进行转移、定容,一旦冷却下来会导致体积偏小,所配溶液浓度偏高;
⑤最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响.
故选:①②.
本题解析:
本题难度:一般
5、计算题 (8分)将一定质量的Mg-Al合金投入500 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加 5 mol· L-1 NaOH溶液至过量,生成的沉淀质量与加入的NaOH溶液的体积关系如下图所示。
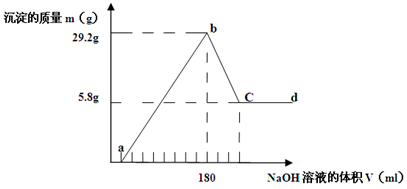
求: (1)原合金中Mg、Al质量各多少克? Mg?g , Al?g。
(2)b-c段反应的离子方程式为?
(3) HCl物质的量浓度?mol/L
参考答案:(1)2.4g? 8.1g (2)Al(OH)3+OH-=AlO2-+2H2O?(3)1.8
本题解析:向溶液中滴加NaOH溶液过程中所涉及反应为:
①H++OH-=H2O?②Mg2++2OH-=Mg(OH)2?③ Al3++3OH-=Al(OH)3
③Al(OH)3+OH-=AlO2-+2H2O
(1)由Mg~Mg(OH)2可知铝粉的质量为: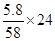 =2.4 g =2.4 g
Al~Al(OH)3可知铝粉质量为: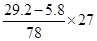 =8.1g =8.1g
(2)在b点时溶液呈中性,酸提供的氢离子与碱提供的氢氧根离子的物质的量相等,则盐酸的物质的量浓度为:c(HCl)×0.5=0.18×5,即c(HCl)=1.8 mol/L
本题难度:一般
|