|
高考化学知识点总结《无机非金属材料》答题技巧(2017年最新版)(二)
2017-09-24 00:14:11
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 海水中提取镁的工业流程如下图所示:
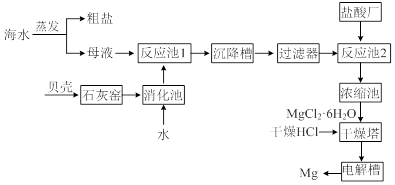
回答下列问题。
⑴用贝壳而不从异地山中开凿石灰石的原因是______________________________。
⑵母液中含有MgCl2,写出反应池1的离子方程式_________________________。
⑶反应池1中,加入Ca(OH)2,使溶液的pH为11时,认为Mg2+沉淀完全[c(Mg2+)<1×10-5mol·L-1],则Mg(OH)2的溶度积约为_______________________。
⑷干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是_______________________________________________________________。
⑸电解槽中先得到的是镁的蒸气,镁蒸气可以在下列_____(填编号)气体氛围中冷却。
A.空气
B.氧气
C.水蒸气
D.氢气
| ⑹镁可用于生产金属钛,主要步骤有:①在高温下,向金红石(主要成分TiO2)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体;②在稀有气体(如氩)氛围和加热条件下,用镁与TiCl4反应可得到钛。写出上述两步反应的化学方程式。
反应①:____________________________________________________________;
反应②:____________________________________________________________。
参考答案:⑴充分利用当地资源,变废为宝,降低生产成本,提高经济和社会效益
⑵Mg2++2OH-=Mg(OH)2↓
⑶1×10-11
⑷营造酸性氛围抑制Mg2+的水解并及时带走水蒸气
⑸D
⑹TiO2+2C+2Cl2 TiCl4+2CO? TiCl4+2Mg TiCl4+2CO? TiCl4+2Mg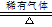 2MgCl2+Ti 2MgCl2+Ti
本题解析:⑴用贝壳而不从异地山中开凿石灰石的原因是:充分利用当地资源,变废为宝,降低生产成本,提高经济和社会效益;
(2)贝壳中的碳酸钙分解能生成氧化钙,氧化钙溶于水生成氢氧化钙,所以母液中含有MgCl2,写出反应池1的离子方程式:Mg2++2OH-=Mg(OH)2↓;
(3)Mg(OH)2的溶度积为: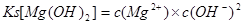 ,所以可得Mg(OH)2的溶度积约为1×10-11; ,所以可得Mg(OH)2的溶度积约为1×10-11;
(4)干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是:营造酸性氛围抑制Mg2+的水解并及时带走水蒸气;
(5)电解槽中先得到的是镁的蒸气,镁蒸气可以在氢气氛围中冷却,因其他物质均能与镁反应;
(6)TiO2+2C+2Cl2 TiCl4+2CO? TiCl4+2Mg TiCl4+2CO? TiCl4+2Mg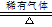 2MgCl2+Ti 2MgCl2+Ti
本题难度:一般
2、选择题 下列有关能源叙述不正确的是
A.沼气是不可再生能源
B.太阳能是新能源
C.石油是化石燃料
D.风能是一次能源
参考答案:A
本题解析:略
本题难度:简单
3、填空题 (1)为了提高生活用水的卫生标准,自来水厂常同时使用Cl2和FeSO4·7H2O进行消毒、净化,以改善水质,其原因是_____________________________。
(2)为了延长液氯杀菌时间,某些自来水厂在用液氯进行消毒处理时,还加入少量液氨,其反应的化学方程式为:NH3+HClO H2O+NH2Cl(一氯氨)。已知NH2Cl比HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是______________________________。 H2O+NH2Cl(一氯氨)。已知NH2Cl比HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是______________________________。
参考答案:(1)氯气杀菌、亚铁盐水解产生的胶体吸附悬浮杂质?
(2)加氨后,次氯酸的释放经可逆反应:NH3+HClO H2O+NH2Cl后相当于缓释作用 H2O+NH2Cl后相当于缓释作用
本题解析:(1)Cl2与FeSO4·7H2O同时使用可以改善水质的原因为:Cl2+H2O HCl +HClO,HClO具有强氧化性,能杀死水中的细菌,起消毒的作用。 HCl +HClO,HClO具有强氧化性,能杀死水中的细菌,起消毒的作用。
Cl2还可将Fe2+氧化成Fe3+:Cl2+2Fe2+====2Cl-+2Fe3+。Fe3+水解:Fe3++3H2O Fe(OH)3+3H+,生成Fe(OH)3胶体。Fe(OH)3胶体具有较强的吸附性能,可吸附水中的悬浮杂质,并能形成沉淀,使水净化。 Fe(OH)3+3H+,生成Fe(OH)3胶体。Fe(OH)3胶体具有较强的吸附性能,可吸附水中的悬浮杂质,并能形成沉淀,使水净化。
(2)根据(1)中的分析,起杀菌消毒作用的是HClO,由题意可知NH2Cl的稳定性大于HClO,向含有Cl2的自来水加入NH3之后会发生如下反应:HClO+NH3 H2O+NH2Cl,从而使不稳定的HClO部分转化为较稳定的NH2Cl。在消毒过程中,随着HClO浓度的降低,上述平衡将向左移动,HClO得以补充,从而延长了液氯的杀菌时间。 H2O+NH2Cl,从而使不稳定的HClO部分转化为较稳定的NH2Cl。在消毒过程中,随着HClO浓度的降低,上述平衡将向左移动,HClO得以补充,从而延长了液氯的杀菌时间。
本题难度:简单
4、填空题 阅读以下内容,回答问题。
冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或H2,或CO)法;③活泼金属置换法;④电解法。四种方法各有优缺点,在工业上均有应用。
(1)一种无色气体A与红热的炭反应,得到另一种无色气体B,B与灼热的氧化铜反应,又得到A,则A、B分别为_______(填序号)。
A.O2、CO2? B.O2、CO? C.CO2、CO? D.CO、CO2
(2)下列说法错误的是_______(填序号)。
A.对废 旧金属的最好处理方法是回收再利用
B.提炼金属要经过矿石的富集、冶炼、精炼三步
C.活泼金属的冶炼都是通过电解其盐溶液制得
D.热还原法中还原剂有焦炭、一氧化碳、氢气或活泼金属等
(3)钛(Ti)有“未来钢铁”之称。工业上常以:TiCl4+2Mg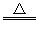 Ti+2MgCl2获得海绵状钛。该反应在下列哪种环境中进行_______ (填序号)。 Ti+2MgCl2获得海绵状钛。该反应在下列哪种环境中进行_______ (填序号)。
A.稀有气体中? B.空气中? C.氮气中? D.CO2气体中
参考答案:(1)C? (2)C? (3)A
本题解析:(1)CO具有还原性,可还原CuO得到Cu;(2)对于Na、Mg、Al等活泼金属不能通过电解其盐溶液制得,而是电解熔融态的氧化物或盐制得;(3)Mg容易和O2、N2、CO2反应,故该反应需在稀有气体中进行
本题难度:一般
5、填空题 ( 14 分)在元素周期表中,锌(30Zn)、镉(48Cd)、汞(80Hg)同属于锌族,锌和汞在自然界中常共生,镉的金属活动性介于锌和汞之间。湿法炼锌过程中产生的铜镉渣中含有Cu、Cd、Zn等多种金属,可用于生产金属镉。镉的主要用途可以用作镍―镉电池,以及用于颜料生产,镉化合物还在PVC稳定剂、发光材料、半导体材料、杀菌剂等方面有广泛的应用。镉的生产流程如图示意如下:
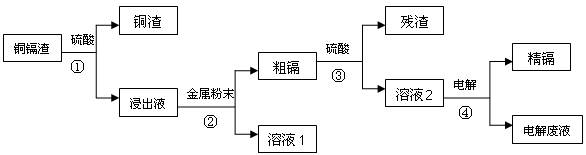 请回答下列问题: 请回答下列问题:
(1)镉元素位于周期表中第?周期,第?族,其原子结构示意图为?;
(2)写出步骤①反应的离子方程式??。
(3)步骤②所加入的金属是?。
(4)步骤④用“溶液2”作电解液,镉在?极析出,该电极材料是
(5)“电解废液”中含有镉,不能直接作为污水排放。目前含镉的废水处理的方式有两种,一种是在含镉污水中加入硫化钠,沉淀镉离子,另一种是加入聚合硫酸铁和聚合氯化铝,沉淀镉离子。写出硫化钠沉淀镉离子的离子方程式?。
参考答案:
(14分)(1)五,ⅡB,
(2)Cd+2H+=Cd2++H2↑,Zn+2H+=Zn2++H2↑
(3)锌?(4)阴、镉?(5)Cd2++S2-=CdS↓
本题解析:略
本题难度:简单
|