微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
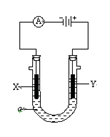
(1)若X是锌、Y是碳棒电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极附近观察到的现象是 。
②Y电极上的电极反应式为 ____________ 。
③利用该原理可以制得的化工原料有 ____________ 。
(2)若要用电解方法精炼粗铜,电解液a选用 溶液,X电极的材料是 。
(3)若要在某铁制小饰品上镀上一层银,则Y电极的材料是 ,
X电极反应式是 ___ 。
参考答案:(1)①有气体产生,溶液变红(各0.5分,共1分)
② 2Cl一-2e一===Cl2 ↑
③H2、Cl2、NaOH(写出1个给0.5分,写出2个及以上给1分)
(2)铜 纯铜
(3)Ag Ag++e-="==" Ag
本题解析:(1)若X是锌、Y是碳棒电极,a是饱和NaCl溶液,该装置为电解食盐水装置,Y为阳极,氯离子在Y极放电,产生了氯气;在X极上产生了氢气和氢氧化钠,所以①由于在两边各滴入几滴酚酞试液,而在X极产生了氢氧化钠,所以在X极附近观察到的现象是为有气体产生,溶液变红;②Y电极上的电极反应式为:2Cl一-2e一===Cl2 ↑;③利用该原理可以制得的化工原料有H2、Cl2、NaOH;(2)若要用电解方法精炼粗铜,电解液a选用铜溶液,X为阴极,故X的材料为纯铜;(3)若要在某铁制小饰品上镀上一层银,则Y电极为阳极,所以Y电极的材料为Ag,X电极的反应式是Ag++e-="==" Ag。
考点:电解池
点评:本题考查了电解池,该考点是高考考查的重点和难点,本题难度适中。
本题难度:一般
2、选择题 已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8的含有Fe2(SO4)3杂质的CuSO4溶液中加入适量的黑色粉末X,充分搅拌后过滤,将滤液用如图所示装置电解,其中某电极增重ag,另一电极上产生标准状况下的气体VmL,下列说法正确的是
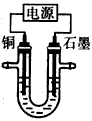
[ ? ]
A.黑色粉末X是铁粉
B.铜电极连接电源正极
C.石墨电极上发生的反应是4OH--4e-=O2↑+2H2O
D.铜的相对原子质量的计算式是
参考答案:C
本题解析:
本题难度:一般
3、填空题 工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1) 右图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是?;NaOH溶液的出口为______(填字母);精制饱和食盐水的进口为_____(填字母);干燥塔中使用的液体干燥剂是____(每空2分)。

(2) 原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加人的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是?(2分)(填序号)。
(3) 多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为??(2分)。 也可转化为
也可转化为 而循环使用。一定条件下,在200C恒容密闭容器中发生反应:
而循环使用。一定条件下,在200C恒容密闭容器中发生反应: ,达平衡后,H2与SiHCL3物质的量浓度分别为0. 140mol/L和0. 020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的物质的量为_______ (2分)mol。
,达平衡后,H2与SiHCL3物质的量浓度分别为0. 140mol/L和0. 020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的物质的量为_______ (2分)mol。
(4)已知1 g阴极产生的气体在阳极产生的气体中完全燃烧时放出92. 3 kj的热量,则该反应的热化学方程式为: ???(2分)。
参考答案:(1)氯气(Cl2);___a___ (填字母);__d___ (填字母);__浓硫酸__(每空2分)。
(2)③①②(2分)。
(3)  (2分)。___6____ (2分)mol。
(2分)。___6____ (2分)mol。
(4) ?(2分)。
?(2分)。
本题解析:略
本题难度:一般
4、选择题 下列说法正确的是

[? ]
A.Cu(s)+2H2O(l)===2Cu(OH)2 (s)+H2(g),该反应可通过上图装置来实现
B.在体积可变的密闭容器中进行反应:CaCO3(s)  CaO(s)+CO2(g)达到平衡后压缩体积,则v(正)、v(逆)均增大,平衡向逆反应方向移动
CaO(s)+CO2(g)达到平衡后压缩体积,则v(正)、v(逆)均增大,平衡向逆反应方向移动
C.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH<0,由该反应可知物质能量关系一定符合:E [ZnSO4(aq)] < E [CuSO4(aq)]
D.在密闭容器中进行反应:HI(g) H2(g)+I2(s)ΔH=-26.5 kJ·mol-1,,则充入1 mol HI,达到平衡后放出26.5 kJ的热量
H2(g)+I2(s)ΔH=-26.5 kJ·mol-1,,则充入1 mol HI,达到平衡后放出26.5 kJ的热量
参考答案:A
本题解析:
本题难度:一般
5、实验题 (9分)利用下图电解装置进行实验。

(1)若a、b是惰性电极,电解质溶液是氯化钠溶液,a极是?极,总反应的离子方程式是?。
(2)若a、b是惰性电极,电解质溶液是硝酸银溶液,b极上的现象是?,总反应的离子方程式是?。
(3)若a、b是惰性电极,电解质溶液是硫酸钾溶液,a极上的电极反应是?,若两极附近分别加入石蕊试液,两极附近的现象是?。
参考答案:(1)阳;2Cl-+2H2O ?Cl2↑+H2↑+2OH-
(2)有银白色固体析出;4Ag++2H2O ?4Ag+O2↑+4H+
(3)4OH--4e-= 2H2O+O2↑;a极附近溶液变红,b极附近溶液变蓝
本题解析:(1)根据电流方向可判断,a是阳极,b是阴极。所以惰性电极电解饱和氯化钠溶液,其总反应式为2Cl-+2H2O ?Cl2↑+H2↑+2OH-。
(2)惰性电极电解硝酸银溶液,则阴极b是银离子发生而析出单质银,阳极是OH-放电,放出氧气,则反应式为4Ag++2H2O ?4Ag+O2↑+4H+。
(3)惰性电极电解硫酸钾溶液,则相当于电解水,阳极是是OH-放电,放出氧气。阴极是氢离子放电生成氢气。所以阳极周围显酸性,阴极周围显碱性。
本题难度:一般