微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列应用不涉及氧化还原反应的是( )
A.Na2O2用作呼吸面具的供氧剂
B.工业上电解熔融状态的Al2O3制备Al
C.工业上利用合成氨实现人工固氮
D.实验室用NH4Cl和Ca(OH)2制备NH3
参考答案:D
本题解析:
本题难度:一般
2、选择题 NaNO2是一种食品添加剂,它能致癌.酸性KMnO4溶液与NaNO2的反应方程式是MnO4-+NO2-+H+→Mn2++NO3-+H2O(未配平).下列叙述中不正确的是( )
A.该反应中NO2-?是还原剂
B.反应过程中溶液的pH?减小
C.生成1?mol?NaNO3时消耗0.4?mol?KMnO4
D.该反应可说明氧化性MnO4->NO3-
参考答案:A、依据化学反应,结合化合价的变化分析NO2-被氧化,做还原剂,故A正确;
B、反应过程中消耗氢离子溶液PH增大,故B错误;
C、2mol高锰酸根离子反应生成5molNO3-,所以生成1?mol?NaNO3时消耗0.4?mol?KMnO4,故C正确;
D、氧化还原反应中氧化剂MnO4-的氧化性大于氧化产物NO3-,故D正确;
故选B.
本题解析:
本题难度:简单
3、填空题 已知反应:2FeCl3+Cu=2FeCl2+CuCl2
(1)请用单线桥法标出电子转移的方向和数目______.
(2)在该反应中,氧化剂是______,氧化产物是______.
(3)当有0.3mol电子发生转移时,发生反应的Cu的质量为______.
(4)请将以上反应改写为离子方程式______.
(5)写出FeCl3的电离方程式______.
参考答案:(1)Cu作还原剂失去2个电子,电子转移数目为2e-,用单线桥法标出电子转移的方向和数目为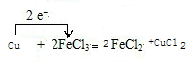 ,
,
故答案为: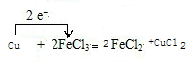 ;
;
(2)Fe元素的化合价升高,则FeCl3为氧化剂;Cu元素失去电子被氧化,则CuCl2为氧化产物,故答案为:FeCl3;CuCl2;
(3)由反应可知,转移2mol电子,反应的Cu为1mol,有0.3mol电子发生转移时,发生反应的Cu的质量为0.3mol2×64g/mol=9.6g,
故答案为:9.6g;
(4)上述反应中只有氯离子不参加反应,该反应的离子反应为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(5)FeCl3为强电解质,完全电离,电离方程式为FeCl3═Fe3++3Cl-,故答案为:FeCl3═Fe3++3Cl-.
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
[? ]
A.氧化还原反应的本质是元素化合价发生变化
B.还原剂是一种能够得到电子的物质
C.物质所含元素化合价升高的反应是还原反应
D.氧化反应和还原反应是同时发生的
参考答案:D
本题解析:
本题难度:简单
5、填空题 工业上利用下列反应进行海水中溴元素的富集:Br2+SO2+2H2O=H2SO4+2HBr.在该反应中,作为氧化剂的物质是______(填化式),作为还原剂的物质是______(填化学式);若反应中生成了?0.1mol?HBr,则转移的电子数为______个.
参考答案:在反应Br2+SO2+2H2O=H2SO4+2HBr中,化合价降低元素Br所在的反应物Br2?是氧化剂,化合价升高元素S所在的反应物?SO2?是还原剂,化合价升高值=化合价降低值=2,所以反应转移电子2mol,反应中生成了2mol?HBr,则转移的电子为2mol,若反应中生成了0.1mol?HBr,则转移的电子0.1mol,数目为:0.1mol×6.02×1023=6.02×1022,
故答案为:Br2;SO2;6.02×1022.
本题解析:
本题难度:一般