微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知空气—锌电池的电极反应为:
锌片:Zn+2OH
参考答案:
本题解析:
本题难度:一般
2、选择题 如图装置所示,铜片上发生的反应为
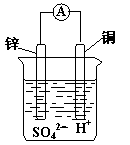
A.Zn2++ 2e一 =Zn
B.2H++2e一= H2 ↑
C.Zn一2e一=Zn2+
D.Cu2++2e一= Cu
参考答案:B
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,锌是负极,铜是正极,溶液中的氢离子在正极得到电子,所以答案选B.
本题难度:一般
3、选择题 某原电池的离子方程式是 Zn + Cu2+ = Zn2+ + Cu,该原电池正确的组成是
?
| 正极
| 负极
| 电解质溶液
|
A.
Cu
Zn
HCl
B.
Zn
Cu
CuSO4
C.
Cu
Zn
CuSO4
D.
Cu
Zn
ZnCl2
|
题型:单选题难度:偏易来源:不详 答案 马上分享给同学