微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
[? ]
A.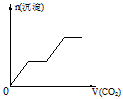
B.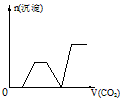
C.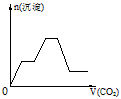
D.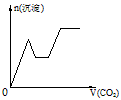
参考答案:C
本题解析:
本题难度:一般
2、填空题 (7分)铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途。
(1)铝制容器不能盛装NaOH溶液,主要原因是什么?(用化学方程式表示)
(2)胃舒平是治疗胃酸(HCl)过多的常用药物,其中含有的有效成分是氢氧化铝,其治疗原理是(用离子方程式表示):
(3)为完全沉淀硫酸铝溶液中的铝元素常加入过量的
参考答案:(1)、 2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
(2)? 3H+ + Al(OH)3 = Al3+? + 3H2O
(3)?氨水
本题解析:(1)铝单质可以和碱反应,使铝进入食品中,有害健康;(2)氢氧化铝可以与盐酸反应,缓解胃酸过多痛苦,发生酸碱中和反应,注意氢氧化铝难溶于水,不能拆成离子形式;(3)要使Al3+全部沉淀出来,不能使用强碱溶液,因为生成的氢氧化铝沉淀能溶于过量的强碱中生成偏铝酸盐而使铝元素不能完全在沉淀中,应用弱碱氨水。
点评:熟悉铝及其化合物的化学性质
本题难度:一般
3、选择题 把铝粉和某铁氧化物xFeO·yFe2O3粉末配成铝热剂,再分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体质量比是8:11,则x:y为?
A.5:7
B.7:5
C.1:2
D.2:3
参考答案:D
本题解析:设生成气体的质量为8g和11g,则根据第二份的实验,铝和烧碱反应生成气体为11g,则铝的物质的量为11/3 mol,而第一份中由于铝粉与铁的氧化物恰好完全反应,所以后面是置换出来的铁与盐酸反应生成的氢气,根据方程式计算,生成8g氢气,需要铁为4mol,而在铝热反应中,铝失电子,铁得电子,可以列出方程式为:
x+2y=4
11=x*2+2y*3
计算可得x=1,y=1.5,所以x:y=2:3
点评:本题结合铝热反应和铝与烧碱的反应,突破点在于先根据比值设一个具体数值来计算铝的物质的量,再根据氧化还原反应电子得失守恒来列方程式计算。
本题难度:简单
4、选择题 用铝箔包着2.3g金属钠,放入50ml水中,放出的H2体积(标准状况)是( )
A.等于2.24L
B.等于1.12L
C.大于1.12L
D.小于1.12L
参考答案:C
本题解析:由2Na+2H2O=2NaOH+H2↑知2.3g金属钠反应生成H2体积(标准状况)是1.12L,但铝箔与生成的NaOH还可以继续反应:2Al+2NaOH+2H2O=2NaAlO2+3 H2↑,所以放出H2体积(标准状况)大于1.12L,答案选C。
本题难度:简单
5、填空题 硫酸铝钾是一种复盐,其电离方程式为KAl(SO4)2====K++Al3++2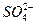 ,向含a mol KAl(SO4)2的溶液中,逐滴加入Ba(OH)2溶液,过程中可能存在以下多个离子方程式
,向含a mol KAl(SO4)2的溶液中,逐滴加入Ba(OH)2溶液,过程中可能存在以下多个离子方程式
A.Ba2++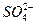 ====BaSO4↓
====BaSO4↓
B.Al3++3OH?====Al(OH)3↓
C.Al3++4OH-====
 +2H2O
+2H2O
D.2Al3++3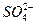 +3Ba2++6OH-====3BaSO4↓+2Al(OH)3↓
+3Ba2++6OH-====3BaSO4↓+2Al(OH)3↓
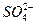 +2Ba2++3OH-====2BaSO4↓+Al(OH)3↓
+2Ba2++3OH-====2BaSO4↓+Al(OH)3↓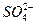 +2Ba2++4OH-====2BaSO4↓+
+2Ba2++4OH-====2BaSO4↓+ +2H2O
+2H2O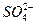 完全沉淀时的离子方程式为_________。
完全沉淀时的离子方程式为_________。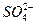 )为a mol·L-1,当滴加完等体积的b mol·L-1 KOH溶液时,反应过程中生成的沉淀恰好完全溶解,则原混合溶液中K+的物质的量浓度为 mol·L-1(用a、b表示)。
)为a mol·L-1,当滴加完等体积的b mol·L-1 KOH溶液时,反应过程中生成的沉淀恰好完全溶解,则原混合溶液中K+的物质的量浓度为 mol·L-1(用a、b表示)。