微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图所示的实验中,投入铝片后?( )
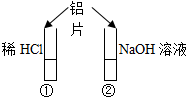
A.①中产生气泡,②中不产生气泡
B.①和②中都不产生气泡
C.①和②中都产生气泡,①中是H2,②中是O2
D.①和②中都产生气泡,且都是H2
参考答案:A、因②中发生2Al+2NaOH+2H2O=2NaAlO2 +3H2↑,则②中产生气泡,故A错误;
B、因①中发生2Al+6HCl=2AlCl3+3H2↑,②中发生2Al+2NaOH+2H2O=2NaAlO2 +3H2↑,则①和②中都产生气泡,故B错误;
C、因①中发生2Al+6HCl=2AlCl3+3H2↑,②中发生2Al+2NaOH+2H2O=2NaAlO2 +3H2↑,则都有气泡,且生成的都是H2,故C错误;
D、因①中发生2Al+6HCl=2AlCl3+3H2↑,②中发生2Al+2NaOH+2H2O=2NaAlO2 +3H2↑,则都有气泡,且生成的都是H2,故D正确;
故选D.
本题解析:
本题难度:简单
2、选择题 下列物质中既能与稀硫酸反应,又能与氢氧化钠溶液反应是
[? ]
(1)NaHCO3?(2)?(NH4)2S?(3)?Al2O3?(4)?Al?(5)?Al?(OH)3
A.(3)?(4)?
B.(3)?(4)?(5)?
C.(1)?(3)?(4)?(5)?
D.全部
参考答案:D
本题解析:
本题难度:一般
3、选择题 将a g铝粉加入过量NaOH溶液中充分反应后,铝粉完全溶解,并收集到标准状况下b L氢气,所得溶液中共有c个溶质离子,反应中转移电子d个。则阿伏加德罗常数(NA)可表示为
A.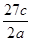
B.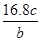
C.
D.
参考答案:C
本题解析:氢气的物质的量是 ,转移电子的物质的量是
,转移电子的物质的量是 ,所以阿伏加德罗常数(NA)可表示为
,所以阿伏加德罗常数(NA)可表示为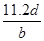 ;铝的物质的量是
;铝的物质的量是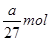 ,转移电子的物质的量是
,转移电子的物质的量是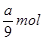 ,所以阿伏加德罗常数(NA)可表示为
,所以阿伏加德罗常数(NA)可表示为 ,C正确;由于溶液中溶质既有氢氧化钠,又有偏铝酸钠,不能用c表示,所以答案选C。
,C正确;由于溶液中溶质既有氢氧化钠,又有偏铝酸钠,不能用c表示,所以答案选C。
点评:该题的关键是明确反应的原理,以及微粒个数与阿伏加德罗常数的关系,如何结合题意灵活运用即可,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生的应试能力。
本题难度:一般
4、填空题 1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近,称为等电子原理。后来,该原理被推广使用于一些具有特殊功能的晶体的发现和人工合成等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
其中:C是无色气体,D为自色沉淀,E溶液的焰色反应中火焰呈黄色。回答以下问题:

(1)写出X的化学式:_______,X属于______晶体(填“原子”、“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:?
写出常温下H与L反应的离子方程式:?。
(3)X与SiC的复合粉末是新一代人规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。(?)+2N2 4X+SiC+3C。
4X+SiC+3C。
参考答案:(1)A1N?原子
(2)AlN+NaOH+H2O====NaAlO2+NH3↑
Al+4H++NO3-=====Al3++2H2O+NO↑
(3)Al4SiC4
本题解析:略
本题难度:简单
5、选择题 在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为

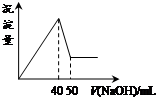
A.1:3
B.1:2
C.1:1
D.2:1
参考答案:C
本题解析:首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为10mL,根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的体积为10mL×3=30mL,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液40mL,计算沉淀Mg2+消耗的氢氧化钠溶液的体积为40mL-30mL=10mL,则n(Mg2+):n(Al3+)=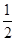 ×10mL:
×10mL: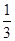 ×30mL=1:2,故原来混合溶液中Al2(SO4)3和MgSO4的物质的量浓度之比为1:1,故选C。
×30mL=1:2,故原来混合溶液中Al2(SO4)3和MgSO4的物质的量浓度之比为1:1,故选C。
本题难度:一般