微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
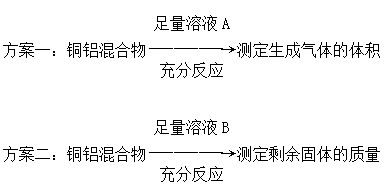
下列有关判断中不正确的是
A.溶液A和溶液B均可以是盐酸或NaOH溶液
B.若溶液B选用浓硝酸,测得铜的质量分数偏大
C.方案一可能产生氢气,方案二可能剩余铜
D.实验室中方案Ⅱ更便于实施
参考答案:B
本题解析:若B为浓硝酸,铝发生钝化,铝表面生成一层致密的氧化膜,导致铝的质量偏大,故测得铜的质量分数偏小,B项不正确。
本题难度:简单
2、计算题 总的物质的量为0.50 mol的Fe粉与Al粉混合物分为等质量的两份;在一份中加入足量
的稀盐酸,在标准状况下产生气体a L;在另一份中加入足量的氢氧化钠溶液,在标准状况下产生气体b L。则a+b的数值不可能是
A.5.6
B.7.3
C.8.2
D.11.2
参考答案:A
本题解析:由反应Fe+2HCl→FeCl2+H2↑、2Al+6HCl===2AlCl3+3H2↑
和2Al+2NaOH+2H2O→2NaAlO2+3H2↑。可知:若两等份之一中含有xmolFe、ymolAl。
即x+y=0.25,22.4(x+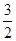 y)=a,22.4×
y)=a,22.4×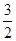 y=b。
y=b。
得出a+b="5.6+44.8y" (0<y<0.25),推出5.6<a+b<16.8
本题难度:一般
3、选择题 蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制碱式碳酸镁的实验步骤如下:?
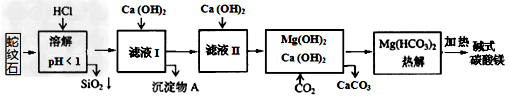
室温下,相关金属氢氧化物沉淀的KSP见下表1
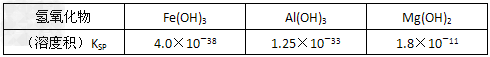
注:①?lg2=0.3,②离子的浓度小于1.0×10-5?mol·L-1时?,可认为该离子沉淀完全。下列说法不正确的是
[? ?]
A.在滤液I中,不能加过量的Ca(OH)2是为了防止Al(OH)3溶解和Mg2+沉淀
B.滤液I中,加Ca(OH)2后Al3+比Fe3+先沉淀完全
C.室温下,用Ca(OH)2把滤液I的pH调节到4.7时,Al3+刚好沉淀完全
D.称18.2g碱式碳酸镁【aMgCO3·b?Mg(OH)2·cH2O】高温加热分解得到6.6g?CO2和8.0g?MgO,由此可知a=3、b=1、c=3
参考答案:B
本题解析:
本题难度:一般
4、推断题 A、B、C是中学化学常见物质,含有同一种元素。其转化关系如下
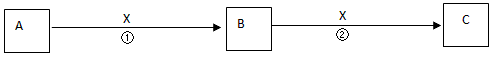
(1)若X为无色无味的气体,是一种常用氧化剂。A为气体化合物,溶于水后所得溶液使红色石蕊试纸呈蓝色。该转化关系是工业制硝酸的反应原理。则A的电子式是________________。
(2)若X为还原剂。将5~6滴A的饱和溶液滴入沸水中,可得到红褐色液体,该液体能产生丁达尔效应。反应②的离子方程式为________________。
(3)若X为一种常见的碱,A、C均为盐,B为白色胶状沉淀,几乎不溶于水,但能凝聚水中的悬浮物。已知Na2S溶液显碱性,向A的溶液中加入Na2S溶液,生成具有臭鸡蛋气味的气体H2S,反应的离子方程式为_____________________。
参考答案:(1)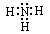
(2)Fe2+ + Zn = Zn2+ + Fe
(3)2Al3+ + 3S2- + 6H2O == 3H2S↑+ 2Al(OH)3↓
本题解析:
本题难度:一般
5、选择题 实验现象是物质性质的反映,下列对实验现象的解释或由此得出的结论不正确的是
[? ]
实验1mol某醇与足量的纳反应
现象
解释或结论
A.
将SO2通入Ba(NO3)2溶液中
溶液变浑浊并有少量气泡冒出
生成BaSO4沉淀和NO气体
B.
1(未打磨)和铝箔2(已打磨)分别在空气中灼烧
铝箔均熔化但不滴落
熔点:Al2O3>Al
C.
向淀粉的水解液中加入新制的氢氧化铜悬浊液加热,充分反应
无砖红色色沉淀生成
该淀粉未水解
D.
1mol某醇与足量的钠反应
生成22.4L氢气(标况下)
该醇为二元醇
参考答案:C
本题解析:
本题难度:一般