|
高中化学知识点讲解《能量的相互转化》试题强化练习(2017年最新版)(四)
2017-09-24 00:22:17
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某学生用如图所示装置对化学反应:2X+Y═2Z进行能量变化情况的研究.当往试管中加入试剂Y时,看到U型管中液面甲处上升,乙处下降.关于该反应的下列叙述:①该反应为放热反应②生成物的总能量比反应物的总能量高③该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来.其中正确的是( )
A.仅②
B.仅①③
C.仅①②
D.仅①②③
|
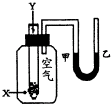
参考答案:当往试管中加入试剂Y时,看到U型管中液面甲处上升,乙处下降.,说明该反应是吸热反应,吸收热量,温度降低热使得集气瓶中气压降低而出现该现象,故①错误,在吸热热反应中,反应物的能量低于生成物的能量,故②正确;该反应过程可以看成是X、Y吸收热量转变成Z的能量,故③错误.
故选:A;
本题解析:
本题难度:一般
2、选择题 有关化学反应热效应及反应自发性的下述描述,其中正确的是
A.由CH3(CH2)2CH3(g)+13/2O2(g)=4CO2(g)+5H2O(g) △H= -2658 kJ·mol-1,可知正丁烷的燃烧热为:-2658 kJ·mol-1。
B.OH(aq)-+ H(aq)+ = H2O(l)△H=-57.3kJ?mol-1, 故1mol醋酸与1molNaOH完全反应,放出的热量一定为57.3kJ
C.2CO(g)+O2(g)===2CO2(g); ΔH=-566 kJ·mol-1,N2(g)+O2(g)===2NO(g);ΔH=+180 kJ·mol-1,则2CO(g)+2NO(g)===N2(g)+2CO2(g)的ΔH=-746 kJ·mol-1
D.若反应2AB(g) C(g) + 3D(g) 在高温下能自发进行,其逆反应在低温下能自发进行,则该正反应的△H<0、△S>0 C(g) + 3D(g) 在高温下能自发进行,其逆反应在低温下能自发进行,则该正反应的△H<0、△S>0
参考答案:C
本题解析:A、燃烧热中水为液体;
B、醋酸的电离吸热,故小于57.3KJ;
C、运用盖斯定律,正确;
D、正反应为吸热
本题难度:一般
3、选择题 强酸与强碱的稀溶液发生中和反应时,中和热的热化学方程式可表示为:
H+(aq)+OH-(aq)══ H2O(l) ΔH="-57.3" kJ·mol-1。有以下4个化学方程式:
①H2SO4(aq)+2NaOH(aq)══ Na2SO4(aq)+2H2O(l)
②H2SO4(aq)+Ba(OH)2(aq)══ BaSO4(s)+2H2O(l)
③1/2H2SO4(aq)+NaOH(aq)══ 1/2 Na2SO4(aq)+H2O(l)
④1/2H2SO4(浓,aq)+NaOH(aq) ══ 1/2Na2SO4(aq)+H2O(l)
其中反应热为-57.3 kJ·mol-1的是
A.①②
B.③
C.④
D.均不符合
参考答案:B
本题解析:①②中生成2mol水,反应热是-114.6kJ/mol;③中生成1mol水,反应热是-57.3kJ/mol;④中浓硫酸溶于水放热,所以实际放出的热量大于57.3kJ,因此正确的答案选B。
点评:该题是基础性试题的考查,试题侧重考查学生对反应热概念的了解掌握程度,有利于培养学生的逻辑思维能力,提高学生分析问题、解决问题的能力。该题的关键是明确,反应热与热化学方程式中的化学计量数成正比,然后灵活运用即可得出正确的结论。
本题难度:简单
4、选择题 有关键能数据如下表所示:

则晶体硅在氧气中燃烧的热化学方程式为
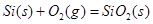 ; ;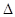 H="-989.2" H="-989.2" 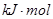  则x的值为 ( ? ) 则x的值为 ( ? )
A.460
B.920
C.1 165.2
D.423.3
参考答案:A
本题解析:在Si晶体中,一个硅原子与4个硅原子成键,每条化学键被两个硅原子共用,故相当于每个硅原子完全占有两条化学键,故反应掉1mol硅,需要断裂2mol的Si-Si,生成1mol的SiO2形成4mol的Si-O键,用吸收的热量减去放出的热量得化学反应的△H,△H=2×176KJ/mol+498.8KJ/mol-4xKJ/mol=-989.2KJ/mol,x=460KJ/mol
本题难度:一般
5、填空题 (14分)合成气是以H2、CO等为主要组成的供化学合成的原料气,回答有关问题:
(1)甲烷在一定条件下与水反应可得合成气,该反应中每转移1.2mol电子,所得合成气在表况下的体积为?L。
(2)合成气在合成氨气时需除去CO,可利用以下反应: CO(g)+H2O(g) CO2(g)+H2(g)? CO2(g)+H2(g)?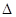 H=-41.16kJ/mol,对于该反应有关表述正确的是?。 H=-41.16kJ/mol,对于该反应有关表述正确的是?。
a.其他条件不变,缩小体系体积增大压强时反应速率不变,所以平衡不移动
b.绝热条件下,若测得该体系温度不再改变,则反应处于平衡状态
c.温度升高,该反应平衡常数增大
d.为提高CO转化率,可适当增加水蒸气用量
某温度下,H2O和CO按体积比5:l充入某恒容反应器,平衡时测得CO与CO2体积比l:9,则该条件下的平衡常数为?(保留两位有效数字)
(3)为除去(2)中生成的CO2,可用碳酸钾溶液吸收,常温下pH=10的碳酸钾溶液中水电离的OH- 的物质的量浓度为?,碳酸氢钾溶液中离子浓度大小顺序为?
(4)CO2和NH3在一定条件下反应生成尿素[CO(NH2)2]:CO2(g)+2NH3(1)=H2O(1)+CO(NH2)2(1),CO2的转化率随温度变化曲线如下,则该反应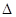 H ?0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理?。 H ?0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理?。
参考答案:(14分,每空2分)(1)17.92L
(2)b d? 2.0
(3)10-4mol/L?[K+]>[HCO3]>[OH]>[H+]
(4)<?净化后重新充入合成塔内,循环利用,提高原料利用率
本题解析:(1)甲烷在一定条件下与水反应的方程式为CH4+H2O→CO+3H2,即每生成4mol气体反应中就转移6ml电子。反应中每转移1.2mol电子,所得合成气在标准状况下的体积为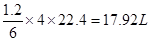 。 。
(2)缩小体系体积增大压强,则反应速率一定会增大,但反应前后气体的体积不变,故改变越强不影响平衡,a不正确。绝热条件下,若测得该体系温度不再改变,说明此时正逆反应速率相等,即达到平衡状态,b正确。正反应放热,温度升高平衡向逆反应方向移动,平衡常数减小,c不正确。增加水蒸气用量虽然可降低自身的转化率,但会提高其它反应物的转化率,d正确。
(3)碳酸钾水解显碱性,促进了水的电离,所以下pH=10的碳酸钾溶液中水电离的OH- 的物质的量浓度为1×10-4mol/L。碳酸氢钾溶液显碱性是因为碳酸氢钾的水解程度大于其电离程度,所以溶液中离子浓度大小顺序为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。
(4)由图像可看出,在等压时温度越高,二氧化碳的转化率越低,所以正反应是放热反应。为了提高原料的利用率,必须循环使用。
本题难度:一般
| 