微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 下列转化关系图中,A、B、C、D、E在常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变浑浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物。

请回答下列问题:
(1)C的电子式为____________。
(2)检验溶液L中金属阳离子的方法是____________________。
(3)反应③的离子方程式为____________________。
(4)F与G的浓溶液反应的化学方程式为____________________。
(5)气体A的密度为2.68 g/L(标准状况),通过计算、推理,可确定A的分子式为____________。
参考答案:(1) (2)取少量溶液于试管中,向溶液中滴加KSCN溶液,无现象,再滴加新制的氯水,溶液变为红色
(2)取少量溶液于试管中,向溶液中滴加KSCN溶液,无现象,再滴加新制的氯水,溶液变为红色
(3)Cl2+2H2O+SO2=4H++2Cl-+SO42-
(4)C+2H2SO4(浓)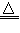 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(5)COS
本题解析:
本题难度:一般
2、填空题 物质的转化关系如下图所示,其中甲可由两种单质直接化合得到,乙为金属单质,
F的溶液中只含一种溶质,G为酸,乙在G的浓溶液中发生钝化。若用两根玻璃棒分别蘸取A、G的浓溶 液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则
液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则
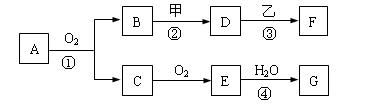
(1)①反应的化学方程式是 ?。
(2)②③两步反应的离子方程式分别是?,
。
(3)在④的反应中,每1molE参加反应,将会有? mol电子发生转移。
参考答案:(1)①反应的化学方程式是4NH3+5O2==4NO+6H2O 。
(2)②③两步反应的离子方程式分别是2Na2O2+2H2O==4Na++4OH-+O2?,
2Al+2OH-+6H2O==2[Al(OH)4]-+3H2?。
(3)在④的反应中,每1molE参加反应,将会有 2/3? mol电子发生转移。
本题解析:略
本题难度:简单
3、简答题 已知A、B、D、E四种物质中均含有同一种短周期元素,该元素原子的最外层电子数是内层电子数的3倍,D为气体单质,E为黑色粉末.如图转化关系中E均起催化作用(某些产物已略去).
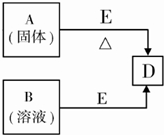
则:
(1)A的化学式为______;B分子的电子式为______;
(2)已知E与含A中某元素的浓酸在一定条件下反应,产生一种含有该元素的气体X.甲同学为探究该气体的性质,设计了如图装置(III中夹持装置已略去).
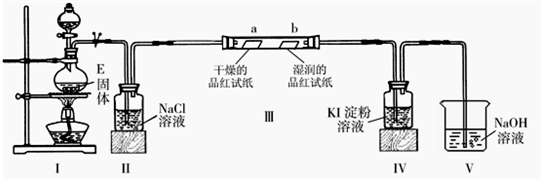
①I中发生反应的离子方程式为______;
②实验开始不久,观察到装置IV中的现象为______;
③实验结束后,该同学在装置III中观察到b的红色褪去,而没有出现“a无明显现象”这一预期现象.为达到实验目的,他在装置______(填装置序号)之间又添加了洗气瓶,该装置的作用是______;
(3)将气体X通入到紫色的石蕊试液中,观察到的现象是______;
(4)气体X能与溶液B反应,生成气体D,试写出该反应的化学方程式:______.
参考答案:已知A、B、D、E四种物质中均含有同一种短周期元素,该元素原子的最外层电子数是内层电子数的3倍,应为O元素,D为气体单质,应为O2,E为黑色粉末,应为MnO2,根据物质的状态和反应条件下可知A为KClO3,B为H2O2,都可在MnO2作用下生成氧气,E与含A中某元素的浓酸在一定条件下反应,产生一种含有该元素的气体X,应为MnO2与浓盐酸的反应,生成X为Cl2,
(1)由以上分析可知A为KClO3,B为H2O2,电子式为
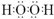
,故答案为:KClO3;
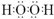
;
(2)①Ⅰ为制取氯气的发生装置,反应的方程式为MnO2+4H++2Cl-??△?.? Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-??△?.? Mn2++Cl2↑+2H2O;
②氯气具有氧化性,与KI反应生成碘单质,淀粉遇碘变蓝色,故答案为:溶液变蓝;
③为验证干燥的氯气不具有漂白性,则通入Ⅲ中的氯气应为干燥后的氯气,应装置II和III添加盛有浓硫酸的洗气装置,用以除去氯气中的水蒸气,
故答案为:装置II和III;除去氯气中的水蒸气(或:干燥氯气);
(3)氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,可使紫色的石蕊试液先变红后褪色,故答案为:紫色的石蕊试液先变红后褪色;
(4)气体Cl2能与溶液H2O2反应,生成气体O2,该反应的方程式为Cl2+H2O2=2HCl+O2,故答案为:Cl2+H2O2=2HCl+O2.
本题解析:
本题难度:一般
4、填空题 (15分)工业上制取铝的流程如下:

注:冰晶石的作用是使E在较低温度下熔化。
(1)试写出下列物质的化学式:
A?,B?,C?,D?,E?。
(2)在用此法制取铝时,分析铝土矿和赤泥(提取Al2O3之后的残渣)所得数据如下:
?
| Al2O3
| Fe2O3
| Na2O
|
铝土矿
| 55%
| 16%
| 0%
|
赤泥
| 15%
| 48%
| 8%
|
试求制取1t Al2O3所需铝土矿和苛性钠的质量。(写过程)
参考答案:(1)NaOH ;NaAlO2 ;Na2CO3 ;Al(OH)3 ;Al2O3( 每空2分)
(2) 1.8 t(2分);? 0.069 t(3分)
本题解析:(1)使用逆推法,电解得铝可知,E为氧化铝,D为氢氧化铝,而B处与二氧化碳发生双水解反应得氢氧化铝,可知C为碳酸钠,A为氢氧化钠。
(2)根据铝土矿中氧化铝的质量分数为55%,所以每生产1t纯净的氧化铝,需铝土矿的质量1/55%=1.8t。再根据反应方程式即可得苛性钠的质量为0.069 t。
点评:本题涉及工业获得金属铝的实验方案知识,是一道工业生产和化学结合的题目,其中工艺流程推断结合化学反应原理,以及铝的化合物性质可以顺利推出,后面的计算也只需要带入方程计算。
本题难度:简单
5、填空题 (本题16分)硫酸钡是唯一的无毒的钡盐,工业上以硫酸钡等为原料通过下列流程反应可以制备锌钡白(BaSO4+ZnS)和过氧化氢。(皓矾为ZnSO4?7H2O)
(1)上述流程中共有7个化学反应,其中有____________个属于氧化还原反应。
(2)写出过氧化氢和物质C的电子式:____________________,_______________。
(3)写出F、G的化学式: F_____________、G_________________。

(4)写出下列化学反应方程式:
反应③__________________________________________________________。
反应⑦____________________________________________________。
(5)取锌钡白固体16.5g溶于100mL 1mol/L的H2SO4溶液中, 放出H2S 气体1008mL(已折算成标准状况)
放出H2S 气体1008mL(已折算成标准状况)
①不计溶液体积变化,所得溶液中氢硫酸的物质的量浓度为________mol/L
②加热驱尽溶液中H2S 后,为使锌离子刚好完全沉淀,应加入 1 mol/L的NaOH溶液_____mL
参考答案:(本题16分)(1)3 (2分)
(2) ?
?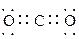 ?(各2分共4分)
?(各2分共4分)
(3)BaCO3? BaO(各1分共2分)
(4)? BaS + ZnSO4 ="=" BaSO4 ↓+ ZnS↓(2分)
BaO2 ?+? H2SO4? ="=?" Ba SO4? +? H2O2(2分)(Ba SO4用了“↓”可不扣分
(5)?①0.05 mol / L?(2分)?② 200 mL(2分)
本题解析:略
本题难度:一般