微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (15分)用磷灰石制磷肥的副产品六氟硅酸钠(Na2SiF6)可制冰晶石(Na3AlF6),冰晶石是电解铝的助熔剂,可降低氧化铝的熔点。下图是工业制铝的流程图:
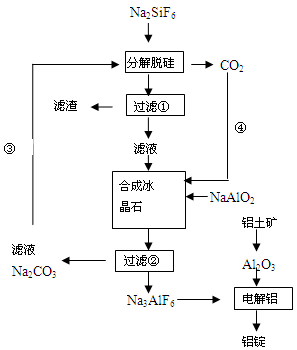
(1)工业上从铝土矿制备较高纯度Al2O3的主要工艺流程需__________个环节,第一步反应的方程式______________________________________________________________
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是________溶液,滤渣是________?。
(3)分解脱硅和合成冰晶石化学反应方程式分别为:_________________、____________________。
(4)工艺过程中③和④的目的是_____________________,碳酸钠和二氧化碳是否够用?。
(5)电解Al2O3制Al时,I=200kA,一天制Al 1.430 t,电解效率是多少??
参考答案:(1)三?Al2O3+2NaOH=2NaAlO2+H2O?
(2)NaF? SiO2
(3)2Na2CO3+Na2SiF6=SiO2↓+2CO2↑+ 6NaF? 6NaF +NaAlO2+2CO2=Na3AlF6↓+2Na2CO3?
(4)Na2CO3和CO2循环使用?理论正好,因有损耗均需补充
(5)88.7%
本题解析:(1)工业上从铝土矿制备较高纯度Al2O3的主要工艺流程,首先加足量的NaOH溶液,使Al转化为AlO2-,再向该溶液中加足量的硝酸或硫酸,这时Al变为Al3+.然后加入足量的氨水得到Al(OH)3沉淀,将其过滤出来,洗涤干净并烘干。最后灼烧Al(OH)3得到纯净的Al2O3。因此需要三个环节。第一步反应的方程式Al2O3+2NaOH=2NaAlO2+H2O。(2)该制备工艺中有两次过滤操作,有流程图可知:在过滤操作①的滤液是NaF;滤渣是SiO2;(3)分解脱硅化学反应方程式是2Na2CO3+Na2SiF6=SiO2↓+2CO2↑+ 6NaF;合成冰晶石化学反应方程式分别为:6NaF +NaAlO2+2CO2=Na3AlF6↓+2Na2CO3 ;(4)工艺过程中③和④的目的是Na2CO3和CO2循环使用,提高物质的利用率、节能、环保。由第三步的方程式可知在理论上碳酸钠和二氧化碳恰好完全反应。而在实际应用使由于物质的利用率不可能100%,所以均需补充。(5)一天制Al 1.430 t,n(e-)=1.430×106g÷27g/mol×3=1.6×105mol.电量Q=1.6×105×6.02×1023×1.6×10-19=1.54×1010,消耗的电能n(e-)=2×105×3600×24=1.73×1010,所以电解效率是(1.54×1010÷1.73×1010)×100%=88.7%.
本题难度:一般
2、填空题 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是___?___________。

(2)为防止氯气尾气污染空气,根据氯水显酸性的性质, 可用?溶液吸收多余的氯气,原理是(用化学方程式表示)_________。根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是__?____(填化学式)
(3)据“北方网”报道,2004年4月15日至16日,位于重庆市江北区的天原化工总厂相继
发生氯气泄漏和爆炸事故。截至记者发稿时,已有9人在事故中失踪死亡,3人受伤,15万人被紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是?。
A.NaOH
B.NaCl
C.KBr
D.Na2CO3
参考答案:(6分)(1)潮湿有色布条褪色而干燥有色布条不褪色?1分
(2)氢氧化钠(NaOH);1分;2NaOH+Cl2=NaClO+NaCl+H2O? 2分;Ca(ClO)2? 1分?(3)D? 1分
本题解析:(1)次氯酸具有漂白性,所以潮湿有色布条褪色而干燥有色布条不褪色。
(2)氯水显酸性,所以可以用氢氧化钠溶液吸收多余的氯气。反应的化学方程式是2NaOH+Cl2=NaClO+NaCl+H2O。漂白粉属于混合物,其有效成分是次氯酸钙。
(3)氢氧化钠具有腐蚀性,A不正确;氯化钠不能吸收氯气;溴化钾吸收氯气,又生成了单质溴,单质溴有毒,所以正确的答案选D。
点评:该题是中等难度的试题,试题注重基础,侧重考查学生的能力,有利于培养学生的逻辑思维能力和发散思维能力,也有助于培养学生的规范答题能力。该题的关键是熟练记住常见物质的化学性质。
本题难度:一般
3、选择题 下图的实验装置用来分离CO2和CO气体并干燥.图中a为止水夹,b为分液漏斗的活塞,通过Y型管和止水夹分别接c、d两球胆,现装置内的空气已排尽.为使实验成功,甲、乙、丙分别盛放的溶液是( )
A.NaHCO3饱和溶液? 12 mol?L-1盐酸? ?18.4 mol?L-1H2SO4
B.Na2CO3饱和溶液? 2 mol?L-1H2SO4 18.4 mol?L-1H2SO4
C.NaOH饱和溶液?2 mol?L-1H2SO4?18.4 mol?L-1H2SO4
D.18.4 mol?L-1H2SO4 NaOH饱和溶液? 18.4 mol?L-1H2SO4
