|
高考化学知识点整理《物质的量》高频试题巩固(2017年最新版)(四)
2017-09-24 00:31:45
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 Ⅰ.实验室配制1mol/L Na2CO3溶液250ml。
(1)需要固体Na2CO3?g;(2)该溶液中的阳离子数目为?个;
(3)需要物质的量浓度为5mol/L 的Na2CO3溶液?ml;
(4)将该溶液与足量稀硫酸反应,产生的气体在标准状况下的体积为?L。
(5)配制该溶液的操作顺序是(用字母表示,不重复使用) ?。
A.称量
B.洗涤
C.定容
D.溶解 E.摇匀 F.转移
| Ⅱ.现有四种可溶性盐,其阳离子分别是K+、Ba2+、Fe3+、Ag+ 中的某一种,阴离子分别是Cl-、SO42-、CO32-、NO3- 中的某一种。小华同学说,不用做实验就可以确定这四种盐,那么他确定的四种盐的化学式分别为:?。
参考答案:(1)26.5?(2)0.5NA或3.01×1023?(3)50?(4)5.6?(5)ADFBCE
Ⅱ.(共4分)? AgNO3?K2CO3? Fe2(SO4) 3? BaCl2? (每写到一个1分,与顺序无关)
本题解析:
Ⅰ.(1)m(Na2CO3)=0.25×1×106g=26.5g;(2)n(Na2CO3)= 0.25×1=0.25mol
n(Na+)="0.5" mol,所以阳离子数目为0.5NA.(3)根据稀释前后溶质的物质的量不变,有1mol/L ×250ml="5" mol/L×V,V=50ml.(4)n(Na2CO3)= 0.25×1=0.25mol,所以,n(CO2)= 0.25mol,V="5.6L." (5)配制溶液的顺序是A.称量D.溶解F.转移 B.洗涤 C.定容 E.摇匀?Ⅱ. 阳离子分别是K+、Ba2+、Fe3+、Ag+,阴离子分别是Cl-、SO42-、CO32-、NO3-组合的四种盐,CO32-只能与K+结合,生成K2CO3,SO42-只能与Fe3+结合,生成Fe2(SO4) 3,Cl-只能与Ba2+结合BaCl2,再就是AgNO3了。
本题难度:一般
2、计算题 (6分)将1mol KClO3加强热至60%分解,将分解后得到的KCl和KClO3溶于过量稀硫酸并加热,试计算可以得到标况下氯气的体积?
参考答案:分解的氯酸钾是0.6mol,则剩余氯酸钾是0.4mol
氯酸钾分解的方程式为2KClO3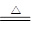 2KCl+3O2↑ 2KCl+3O2↑
则生成0.6mol氯化钾
又因为ClO3-+5Cl-+6H+=3Cl2↑+3H2O
所以氯化钾不足
因此生成氯气是0.6mol×3÷5=0.36mol
在标准状况下的体积是0.36L×22.4L/mol=8.064L
本题解析:考查根据方程式碱进行的有关计算。
本题难度:一般
3、选择题 把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
[? ]
A.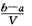 mol·L-1 mol·L-1
B.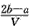 mol·L-1 mol·L-1
C.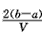 mol·L-1 mol·L-1
D.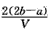 mol·L-1 mol·L-1
参考答案:D
本题解析:
本题难度:一般
4、选择题 NA代表阿伏加德常数,下列说法正确的是
A.标准状况下,22.4LCCl4含有NA个CCl4分子
B? 2g氢气所含原子数目为NA
C?在常温常压下,11.2L氮气所含的原子数目为NA
D? 17g氨气所含电子数目为10NA
参考答案:D
本题解析:标准状况下,四氯化碳不是气态,不能适用于气体摩尔体积,A不正确;2g氢气的物质的量是1mol,所含原子数目为2NA,B不正确;常温常压下,11.2L氮气的物质的量不是0.5mol,C不正确,所以答案选D。
点评:阿伏加德罗常数是历年高考的“热点”问题,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。
本题难度:一般
5、选择题 下列溶液中物质的量浓度为1mol/L的是?(?)
A.将40gNaOH固体溶解于1L水中
B.将22.4L氯化氢气体溶于水配成1L溶液
C.将1L10 mol/L的浓盐酸与9L水混合
D.10gNaOH固体溶解在水中配成250mL溶液
参考答案:D
本题解析:A、应该配成1L的溶液;
B、不是标况下,22.4L不一定为1mol;
C、最后溶液体积,不一定为10L
本题难度:简单
| 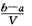 mol·L-1
mol·L-1 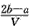 mol·L-1
mol·L-1 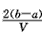 mol·L-1
mol·L-1 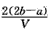 mol·L-1
mol·L-1