微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业上用硫酸和废铁屑制备硫酸亚铁时,为了提高产品的质量,常采取的措施是(? )
A.硫酸过量
B.铁屑过量
C.硫酸和铁的物质的量之比为1︰1
D.需要用浓H2SO4
参考答案:B
本题解析:亚铁离子容易被氧化生成铁离子,所以需要铁过量,以防止亚铁离子的氧化。答案选B。
本题难度:简单
2、选择题 下列反应的产物中,一定不含有+ 2价铁元素的是
A.铁与盐酸
B.铁与氯气
C.铁与氯化铁溶液
D.铁与稀硝酸
参考答案:B
本题解析:A、无论谁过量,铁与盐酸反应均能生成FeCl2、H2,错误;B、无论谁过量,铁与氯气反应均生成FeCl3,正确;C、无论谁过量,铁与FeCl3溶液反应均能生成FeCl2,错误;D、铁过量时,铁与稀硝酸反应均能生成Fe(NO3)2、NO、H2O,错误。
本题难度:一般
3、实验题 试简述在FeCl3溶液中加入NaOH溶液时的反应现象,并写出有关反应的化学方程式。
现象:______________________________________________;
化学方程式:______________________。
参考答案:现象:生成红褐色沉淀
化学方程式:FeCl3+3NaOH= Fe(OH)3↓+3NaCl
本题解析:Fe3+与OH-发生反应生成红褐色的沉淀。
点评:本题考查了Fe3+与碱溶液间的反应,完成此题,可以依据从教材中所学的知识来做答。
本题难度:简单
4、填空题
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A发生铝热反应,产物中有单质B生成,
②另取20 g A全部溶于0.15 L 6.0mol/L的盐酸中,得溶液C,
③将①中得到的单质B和溶液C反应,放出1.12 L(标准状况)气体,同时生成溶液D,还残留有固体物质B,
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是_________,产物中的单质B是____________。
(2)②中所发生的各反应的化学方程式是_______________________________
(3)③中所发生的各反应的离子方程式是_______________________________
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为_________,c(Fe2+)为_________。
参考答案:(1)插上Mg条并将其点燃;Fe
(2)Fe2O3+6HCl = 2FeCl3+3H2O;MgO+2HCl = MgCl2+H2O
(3)Fe+2H+ = Fe2++H2↑;Fe+2Fe3+ = 3Fe2+
(4)0.67 mol/L;2.3 mol/L
本题解析:
本题难度:一般
5、填空题 (10分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为
97.0%~103.0%)的主要流程如下:
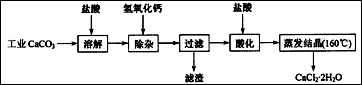
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量
Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是??。
(2)酸化操作是加入盐酸,调节溶液的pH为4.0,其目的有:①将溶液中的少量
Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③??。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶
中定容;b.量取25.00mL待测液于锥形瓶中;c.用0.05000mol·L-1 AgNO3溶液
滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
①上述测定过程中需用溶液润洗的仪器有:??。
②计算上述样品中CaCl2·2H2O的质量分数为:??。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可
忽略),其可能原因有:??;??。
参考答案:(1)取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3沉淀完全
(2)防止溶液吸收空气中的CO2
(3)①酸式滴定管? ②99.9% ③样品中存在少量的NaCl ,少量CaCl2·2H2O 失水
本题解析:(1)Fe(OH)3若没有沉淀完全,则会有Fe3+存在,检验Fe3+的存在用KSCN溶液最好,检验时一定要取上层清液,检验现象才能明显;
(2)空气中的CO2会影响产品的纯度,所以应该防止溶液吸收空气中的CO2。
(3)①滴定实验中,需润洗的仪器有滴定管、移液管,该实验是用 AgNO3溶液滴定
待测液的,所以需要润洗的仪器一定有酸式滴定管。
② 根据关系式:CaCl2·2H2O? ~? 2AgNO3
147? 2
α×0.7500×25/250? 0.05000×0.02039
解得:α=0.9991=99.9%
③根据反应:CaCl2·2H2O ~? 2Cl-~? 2AgNO3
若Cl-偏多,则滴定的结果就会偏高,所以样品中若混有含氯量高于CaCl2的
或CaCl2·2H2O 晶体中的结晶水失去一部分都能使CaCl2·2H2O的质量分数偏高;
本题难度:一般