|
高中化学知识点讲解《化学反应进行的方向》高频考点巩固(2017年模拟版)(八)
2017-09-24 00:37:15
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以下反应可以用熵判据来解释的是
A.硫酸铜饱和溶液降低温度时有晶体析出
B.(NH4)2CO3(s)==NH4HCO3(s)+NH3(g) △H=+74.9kJ/mol
C.CaO(s)+CO2(g)==CaCO3(s) △H="-175.7kJ/mol"
D.2H2(g)+O2(g) ==2H2O(l) △H=-285.8kJ/mol
|
参考答案:B
本题解析:
试题解析:硫酸铜饱和溶液降低温度时有晶体析出是一个放热的熵减小的反应,不能用熵判据解释,故A错误;反应的△H>0,△S>0,△H-T△S<0,反应能自发进行,主要取决于△S的大小,故B正确;反应的△H<0,△S<0,要使△H-T△S<0,反应能自发进行,主要取决于△H的大小,故C错误;反应的△H<0,△S<0,要使△H-T△S<0,反应能自发进行,主要取决于△H的大小,故D错误。
考点:反应自发性的判据
本题难度:一般
2、填空题 (14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) CO(g)+3H2(g) 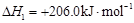
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g) CH3OH(g) 
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。

①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2) = 。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。 CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。
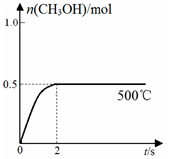
①反应(ii)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,
原因是 (用化学方程式表示)。
③在500℃恒压条件下,请在上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g) HCOOCH3(g)  ,科研人员对该反应进行了研究,部分研究结果如下: ,科研人员对该反应进行了研究,部分研究结果如下:
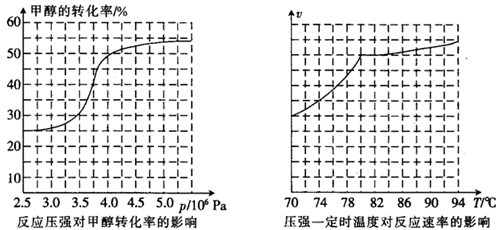
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 。 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
参考答案:(14分)
(1)①0.003mol·L-1min-1 (2分) ②< (1分) ③3:1 (2分)
(2)① 低温 (1分) ②Cu2O+CO 2Cu+CO2 (2分) 2Cu+CO2 (2分)
③ 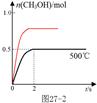 (画出达平衡时间小于2s给1分;画出平衡时纵坐标高于恒容时给1分。共2分。) (画出达平衡时间小于2s给1分;画出平衡时纵坐标高于恒容时给1分。共2分。)
(3)①4.0×106 (2分) ②低于80℃,反应速率较小;高于80℃时,温度对反应速率影响较小,又因反应放热,升高温度时平衡逆向移动,转化率降低(答出前者给1分;答出后者即给2分;)
本题解析:(1)①100℃时达到平衡的时间为5min,甲烷的转化率是0.5,则甲烷的浓度减少1.0mol×0.5/100L=5×10-3mol/L,则氢气的浓度增加5×10-3mol/L×3=0.015mol/L,v(H2) ="0.015mol/L/5min=" 0.003mol·L-1min-1;
②温度相同时,增大压强,平衡逆向移动,则甲烷的转化率减小,所以p1<p2;
③原料气中甲烷与二氧化碳体积分别是x、y,则(i)中产生CO的体积是x,氢气的体积是3x;二氧化碳与氢气的反应中消耗氢气的体积是y,生成CO的体积是y,所以最终氢气的体积是3x-y,CO的体积是x+y,二者恰好反应的体积比CO:H2=1:2=(x+y):(3x-y),解得x:y=3:1;
(2)①反应(ii)是熵减的反应,所以若反应自发进行,则一定有 <0,根据△G=△H-T△S<0反应自发,△S<0,则T应较小,所以该反应在低温下可能自发进行; <0,根据△G=△H-T△S<0反应自发,△S<0,则T应较小,所以该反应在低温下可能自发进行;
②因为氧化亚铜与CO发生反应生成Cu和二氧化碳气体,所以体系内含有二氧化碳,平衡逆向移动,则不利于氧化亚铜被CO还原,从而维持Cu2O的量不变,化学方程式是Cu2O+CO 2Cu+CO2; 2Cu+CO2;
③原平衡是在恒容条件下,压强减小,所以保存压强不变时,则容器的体积减小,相当于在原平衡的基础上,增大压强,平衡正向移动,则甲醇的物质的量增大,但仍是小于1mol,同时压强增大,反应速率加快,达到平衡的时间缩短,则对应的图像为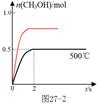 ; ;
(3)①根据图可知,“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”三种压强下,3.5×106Pa时甲醇的转化率是30%,4.0×106Pa是甲醇的转化率是50%,而5.0×106Pa比4.0×106Pa增大了1.0×106Pa,但甲醇的转化率还增大不到5%,对设备的要求更高,但转化率增大的程度不大,所以最适宜的压强是4.0×106Pa;
②根据图27-3可知,温度低于80℃,反应速率较小;高于80℃时,曲线较平缓,说明温度对反应速率影响较小,又因反应放热,升高温度时平衡逆向移动,甲醇转化率降低,所以实际工业生产中采用的温度是80℃。
考点:考查对物质制备过程的分析,设计化学平衡,对图像的分析,反应条件的判断
本题难度:困难
3、选择题 在下面的自发过程中,你认为其中能用熵判据解释的是
A.水由高处流向低处
B.2H2(g)+O2(g)=2H2O(l) ΔH=-483.6 kJ/mol
C.墨水滴在水中会扩散到整个水体
D.-10℃的液态水自动结冰成为固态
参考答案:C
本题解析:熵表示物质的混乱度,在相同条件下,同一种物质的在气态时熵值最大,液态其次,固态时熵值最小,所以选项C可以用熵判据解释。而选项A、B、D都应该用焓变来解释,即都是能量减少的过程,所以答案选C。
本题难度:简单
4、选择题 以下说法中正确的是(? )
A.△H<0的反应均是自发反应
B.自发进行的反应一定能迅速进行
C.冰在室温下自动熔化成水,是熵增的重要结果
D.高锰酸钾加热分解是一个熵减小的过程
参考答案:C
本题解析:A.△H<0的反应均是自发反应,不一定,如碳的燃烧,所以是放热反应,但是常温下还是不自发的,需要加热后才是自发反应。
B.自发进行的反应一定能迅速进行 ,不一定,反应自发与否和反应的快慢没有直接的联络。
C.冰在室温下自动熔化成水,是熵增的重要结果 ,正确。
D.高锰酸钾加热分解是一个熵减小的过程 ,是熵增大的过程;故选C 。
点评:对于反应的自发性判断依据是△G=△H-T△S △G——吉布斯自由能。
△H——焓变(△H<0为放热反应,△H>0为吸热反应)。
△S——熵(物质混乱度的量度,如固体变成气体,混乱度增加,△S>0)。
T——温度 判断反应能否自发进行用吉布斯自由能判据。
如果△G<0 反应可以自发进行;反之则不可以自发进行。
恒温恒压下:
当△H<0,△S>0时,反应自发进行;
当△H>0,△S<0时,反应不自发进行;
当△H>0,△S>0或△H<0,△S<0时,反应是否自发与温度有关,
一般低温时焓变影响为主;高温时,熵变影响为主,而温度影响的。
大小要看△H和△S的具体数值而定。
反应总是在一定条件下进行的。要讨论反应的自发性,也要指明反应条件。如果没有交代反应条件,只讲“某某反应不自发”“某某反应自发”,实际上是指在常温常压下进行的反应。“一定条件”指“一定的温度一定压强”。例如,反应 CaCO3=" CaO" + CO2↑ 在常温常压是非自发的,而在高温下则是自发发生的。 用吉布提自由能计算公式(△G=△H-T△S)来判断反应能否自发进行时,可以看到T对△G的值有影响,在某些情况下,可能决定△G是大于0还是小于0;式中△H 是一个与温度、压强有关的物理量。因此,讨论△G是大于0还是小于0,实际上也是在一定温度与压强下进行的。
本题难度:一般
5、选择题 家用管道煤气的成分是CO、H2、CH4,10 L这种管道煤气充分燃烧,生成CO2和H2O,?同温同压下消耗空气50 L(空气中氧气的体积分数为0.2)。?则该管道煤气中CO、H2、CH4的体积之比可能是 (? )
A.1:1:1
B.3:5:4
C.2:4:5
D.1:6:4
参考答案:AB
本题解析:略
本题难度:简单
|