微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )?
A.氯气具有漂白性,所以可用氯气漂白织物?
B.氧化钠和过氧化钠都是氧化物,所以都是酸性氧化物?
C.将过氧化钠加入新制氯水中,所得溶液中有两种盐?
D.铜丝、铁丝与氯气反应时因没有氧气参加,所以都不能说是燃烧?
参考答案:C?
本题解析:氯气作漂白剂时实际起漂白作用的是次氯酸,所以需要用湿润的氯气才可以;B中氧化钠是碱性氧化物;任何剧烈的发热发光现象都可以称为燃烧。?
本题难度:简单
2、简答题 (1)有一瓶被漂白过的品红试液,甲同学认为是被Cl2漂白,乙同学则认为是被SO2漂白了,请用简单的实验方法判断出到底哪位同学的猜测是真的______.
(2)25℃时,0.1mol?L-1的醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大.对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,[OH-]增大了,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使[H+]减小,因此溶液的pH增大.
①为了验证上述解释哪种正确,继续做如下实验:向0.1mol?L-1的醋酸溶液中加入少量下列物质中的______(填写编号),然后测定溶液的pH.
A、固体CH3COOK?B、固体CH3COONH4
C、气体NH3?D、固体NaHCO3
②若甲同学的解释正确,溶液的pH应______;若乙同学解释正确,溶液pH的值应______填(“增大”、“减小”或“不变”)
参考答案:(1)氯气和二氧化硫的漂白原理不同,前者不可逆,后者可逆,如加热漂白过的试液,如仍变红色,则乙同学对,否则,甲同学对,
故答案为:加热漂白过的试液,如仍变红色,则乙同学对,否则,甲同学对;
(2)①CH3COONH4溶液呈中性,加入CH3COONH4,而其它三种溶液都呈碱性,不能判断甲乙两同学的解释是否正确,
故答案为:B;
②CH3COONH4溶液呈中性,加入CH3COONH4,如pH不变,说明是由于水解的原因,如pH变大,是由于醋酸根离子抑制了醋酸的电离,使[H+]减小,
故答案为:不变;增大.
本题解析:
本题难度:一般
3、选择题 已知:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体,发生反应:
KClO3+6HCl=3Cl2↑+KCl+3H2O;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.
下列判断正确的是( )
A.实验①生成的气体能使湿润的淀粉KI试纸变蓝
B.①中反应被氧化和被还原的氯元素的质量比为6:1
C.实验②生成溶液中加入KSCN溶液,产生血红色沉淀
D.实验②证明Fe2+既有氧化性又有还原性
参考答案:A、根据氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,则由反应①可知氧化性KClO3>Cl2,由反应②可知Cl2>Fe3+,由反应③可知Fe3+>I2,则可得氧化性Cl2>I2,所以将氯气通入湿润的淀粉KI试纸中,氯气能置换出碘单质,试纸变蓝,故A正确;
B、在反应KClO3+6HCl=3Cl2↑+KCl+3H2O中,KClO3中Cl元素的化合价由+5价降到0价,1molKClO3在反应中得到5mol电子,HCl中Cl元素的化合价由-1价升高到0价,根据氧化还原反应得失电子数目相等可知,1molKClO3氧化5molHCl,则反应呗氧化和被还原的氯元素的质量比为5:1,故B错误;
C、实验②生成溶液中含有Fe3+离子,加入KSCN溶液,生成Fe(SCN)3,为溶于水的血红色物质,故C错误;
D、在实验②中,Fe2+被氧化产生Fe3+离子,表现出Fe2+离子的还原性,故D错误.
故选A.
本题解析:
本题难度:一般
4、填空题 氢溴酸(HBr)是一种与盐酸化学性质相似的物质,阳离子相同的溴盐与氯盐溶解性也比较相似,现有以下六种物质:Fe、Fe2O3、CO2、Cu(OH)2、CaCO3、Na2SO4,请从中选取物质,写出能与氢溴酸反应的化学方程式(可不填满,不反应的写出倒扣1分,本题扣到0分为止):
(1)??
(2)??
(3)??
(4)??
(5)??
(6)??
参考答案:(1)Fe + 2=FeBr2 + H2↑?(2)Fe2O3 + 6HBr =2FeBr3 3H2O
(3)Cu(OH)2 + 2HBr =CuBr2 +2H2O? (4) CaCO3 + 2HBr =CaBr2 + CO2 ↑+ H2O
本题解析:Fe为活泼金属,可以与HBr反应置换出氢气,Fe2O3为碱性氧化物,可以与酸反应。Cu(OH)2与酸发生酸碱中和。CaCO3与酸反应,利用强酸制弱酸,可以生成二氧化碳。
本题难度:简单
5、填空题 现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。已知
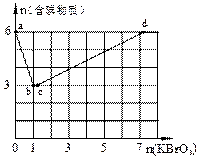
①BrO3-+6I一+6H+=3I2+Br-+3H2O;
②2BrO3- +I2 = 2IO3- + Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为?,还原产物是?。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式?。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由
?。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值
为?。
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为?;阴极观察到的现象是?;
参考答案:(1)1:6(2分);KBr;(2分)
(2)BrO3-+ 5Br- + 6H+ =3Br2 + 3H2O(2分);
(3)不正确(1分);该反应I2作还原剂,Br2还原产物,应得出还原性I2>Br2(合理即可,2分);
(4)7.2mol (2分)?
(5)2I――2e-=I2(或 I-+6OH――6e-=IO3-+3H2O)(2分);有气泡产生
本题解析:略
本题难度:一般