微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质中不能与乙酸反应的是
A.Cu(OH)2
B.Na
C.CH3CHO
D.Na2CO3
参考答案:C
本题解析:略
本题难度:简单
2、选择题 “浓硫酸可用铁罐贮存,但其外表常有严重的腐蚀现象”这句话体现了浓硫酸的
[? ]
A.强氧化性和脱水性
B.强氧化性和吸水性
C.不挥发性和酸性
D.脱水性和吸水性
参考答案:B
本题解析:
本题难度:简单
3、填空题 硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在____的郊区。(填选项的序号) A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1 t 98%的硫酸需消耗3.6×105kJ能量。请通过计算判断,若反应SO2(g)+1/2O2(g)=SO3(g);△H= -98.3kJ/mol-1放出的热量能在生产过程中得到充分利用,则每生产l t 98%的硫酸只需外界提供(或可向外 界输出)________千焦能量。
(3) CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3,和SO2,该反应的化学方程式为
______________________。
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4 (由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)。

已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因
___________________
参考答案:(1)C
(2)6.23×103
(3) 4CuFeS2+ 13O2=4CuO+ 2Fe2O3+8SO2
(4)SO2转化为SO3是正反应放热的可逆反应,随温度升高,SO2的转化率减小;SO3物质的量减少,所以 CuSO4的量减少
本题解析:
本题难度:一般
4、选择题 一定条件下将质量为X g的有机物在O2中完全燃烧,燃烧后全部产物通过足量Na2O2层,过氧化钠的质量增重Y g,下列对应关系一定正确的是?
序号
| 有机物
| X
| Y
|
A
| C2H4
| m
| 15m/7
|
B
| HCOOH
| m
| 15m/23
|
C
| CH3OH和CH3COOH的混合物
| m
| 2m/3
|
D
| HCOOH与CH3COOCH3的混合物
| m
| 2m
参考答案:AB
本题解析:解此题需掌握两个原则即:1、烃和烃的含氧衍生物完全燃烧时生成二氧化碳及水且生成的二氧化碳及水的物质的量取决于一摩尔烃和烃的含氧衍生物分子中所含碳原子及氢原子的物质的量;2、2Na2O2+2CO2=2Na2CO3+O2? (1)? 2Na2O2+2H2O=4NaOH+O2? (2)
据(1)式知过氧化钠每吸收2摩尔二氧化碳放出一摩尔氧气就使其质量增加56克;(2)式则说明过氧化钠每吸收2摩尔水放出一摩尔氧气就使其质量增加4克.
答案A 正确 1摩尔乙烯分子含两摩尔碳原子和4摩尔氢原子即1摩尔乙烯分子完全燃烧时生成2摩尔二氧化碳和2摩尔水,而m克乙烯是m/28摩尔的乙烯,则完全燃烧时生成二氧化碳及水均为m/14摩尔,那么使燃烧产物通过过氧化钠层时就会使其质量分别增加m/28*56/2=2m克{由(1)知}和m/14*4/2=m/7克{由(2)知},故增加的总质量为2m+m/7=15m/7克,所以A正确;
答案B正确?一摩尔HCOOH中含一摩尔碳原子和2摩尔氢原子,完全燃烧时生成一摩尔二氧化碳和一摩尔水,而m克HCOOH是m/46摩尔的HCOOH,则完全燃烧时生成二氧化碳及水均为m/46摩尔,由(1)知过氧化钠增加的质量为m/46*56/2=14m/23克;由(2)知过氧化钠增加的质量为m/46*4/2=m/23克,两者之和为15m/23克,故B正确;
答案C 和答案D 可用极值假设法即如C:可设 m克有机物全是CH3OH或全是CH3COOH完全燃烧时将产物通过过氧化钠层时质量增加的量分别计算与2m/3相比较,若2m/3落在两值之间则合理,否则不合理,由此可否定C、D答案。
本题难度:一般
5、简答题 某校两个班的化学研究性学习小组,在学习了铜和浓硫酸的反应后分别探究足量的锌与浓硫酸反应的过程.一班小组设计了下图装置:
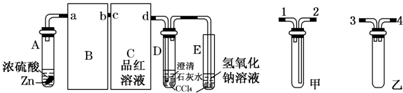
试回答:
(1)请从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接____________接d(用序号表示).
(2)D、E两支试管中CCl4的作用是______.
(3)本实验能证明浓硫酸具有强氧化性的实验现象为______.
(4)D中出现浑浊的离子方程式为______.
(5)某学生注意观察到:实验开始后,C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中出现浑浊;反应一段时间后,C、D、E中的气泡量又会明显增加.请用化学方程式表示“反应一段时间后气泡量又会明显增加”的原因是______.
二班小组设计了下图装置:

(6)分析出二班小组的设计意图是______.
(7)装置B中的药品是______.
(8)能证明产生SO2和H2先后顺序的实验现象是______.
参考答案:Zn+2H2SO4?(浓)═ZnSO4+SO2↑+2H2O,
(1)通常状况下,1体积水中可溶解40体积的二氧化硫气体,装置乙可防止二氧化硫与品红作用时被吸入锌与硫酸反应的容器中,二氧化硫与品红作用,需长管进,
故答案为:3(或4),4(或3)接b,c接2,1;
(2)二氧化硫易溶于水,难溶于四氯化碳,二氧化硫通过四氯化碳,然后再与澄清的石灰水反应,起缓冲作用,可防止倒吸,
故答案为:防倒吸;
(3)二氧化硫可使品红溶液褪色,可检验二氧化硫的存在,
故答案为:C中品红溶液褪色;
(4)二氧化硫和澄清的石灰水反应生成亚硫酸钙和水,亚硫酸钙为难溶于水的沉淀,
故答案为:Ca2++2OH-+SO2═CaSO3↓+H2O;
(5)锌为较活泼的金属,在金属活动顺序表中排在氢的前面,所以锌和稀硫酸反应生成硫酸锌和氢气,
故答案为:Zn+H2SO4(稀)═ZnSO4+H2↑;
(6)二班小组设计的装置,先用白色的无水硫酸铜检验水的存在,后用品红检验二氧化硫的存在,用高锰酸钾氧化二氧化硫除去二氧化硫,浓硫酸具有吸水性,除去水,锌和稀硫酸反应生成氢气和硫酸锌,氢气通过氧化铜生成铜和水,水蒸气遇无水硫酸铜变蓝色,可检验氢气的存在,
故答案为:验证产物中先产生水、SO2,后产生H2;
(7)水蒸气遇无水硫酸铜变蓝色,检验水的存在,
故答案为:无水CuSO4(或无水硫酸铜);
(8)二氧化硫可使品红溶液褪色,C中品红褪色,可检验二氧化硫的存在,高锰酸钾氧化二氧化硫可除去二氧化硫,D中酸性高锰酸钾不再褪色后,说明二氧化硫已经除尽,锌和稀硫酸反应生成氢气和硫酸锌,氢气通过氧化铜生成铜和水,F中有红色物质生成,说明有铜生成,G中无水硫酸铜变蓝,说明有水生成,说明有氢气产生,
故答案为:C中品红褪色,D中酸性高锰酸钾不再褪色后,F中有红色物质生成,G中无水硫酸铜变蓝;
本题解析:
本题难度:一般
|