微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应
CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应
B.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解去除
C.室温下,将浓度为0.1mol.L?1HF溶液加水稀释,其电离平衡常数和c(H+)/c(HF)均不变
D.电解精练铜时,阳极泥中常含有金属金、银、锌等。
参考答案:B
本题解析:反应是放热反应,还是吸热反应,与反应条件无关。只与反应物和生成物总能量的相对大小有关系,A不正确。B正确,符号沉淀转化的特点。稀释有利于电离,所以在稀释过程中,氢离子的物质的量是增加的,HF分子的个数是减小的,因此c(H+)/c(HF)是增大的,C不正确。锌的活泼性强于铜的,所以阳极泥中不可能含有锌,D不正确。答案选B。
本题难度:一般
2、选择题 对于敞口容器中的化学反应Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ,下列叙述 不正确的是
不正确的是

参考答案:A
本题解析:本反应是一个放热反应,同时是氧化还原反应,其中锌失电子,有两个电子转移,可知BCD均正确!对于A来说,Zn是可以用来表示反应速率的,只要用它的质量消耗速率或是摩尔消耗速率就可以。只是不能用其浓度的改变速率表示,因为固体的浓度都是100%,是不会改变的。
本题难度:一般
3、选择题 热激活电池可用作火箭、导弹的工作电池。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池的总反应方程式为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是(? )
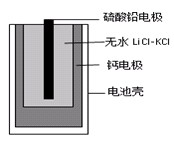
A.常温时,在正负极间接上电流表或检流计,指针不偏转B.放电过程中,Li+向负极移动
C.每转移0.1mol电子,理论上生成20.7gPb
D.正极反应式:Ca +2Cl--2e-=CaCl2
参考答案:A
本题解析:A、常温时,无水LiCl-KCl呈固态,不会导电,正确;B、在原电池中,阳离子向正极移动,错误;C、铅由+2价降到0价,转移电子2mol。所以生成20.7gPb转移电子0.2mol;D、正极发生的是还原反应。
本题难度:一般
4、选择题 综合下图判断,下列正确的说法是
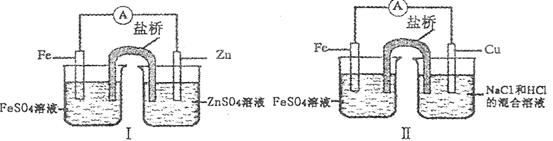
A.装置I和装置II中负极反应均是Fe-2e-=Fe2+
B.装置I和装置II中正极反应均是O2+4e-+2H2O=== 4OH-
C.装置I和装置II中盐桥中的阳离子均向右侧烧杯移动
D.放电过程中,装置II右侧烧杯中溶液的pH增大
参考答案:D
本题解析:原电池中较活泼的金属是负极,则装置I和装置II中负极分别是锌和铁,正极分别是铁和铜,前者是亚铁离子被还原,后者是氢离子被还原。原电池中阳离子向正极移动,所以只有选项D是正确的。答案选D。
本题难度:简单
5、选择题 下列说法不正确的是
[? ]
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱
参考答案:AC
本题解析:
本题难度:一般