微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 200℃时,11.6 g CO2和水蒸气的混合气体与过量的Na2O2充分反应后,固体质量增加了3.6 g,再将反应后剩余固体冷却后加入含有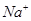 、
、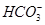 、
、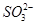 、
、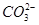 等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是 ( )
等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是 ( )
A.原混合气体的平均摩尔质量为23.2 g/mol
B.混合气体与Na2O2反应过程中电子转移的物质的量为0.25 mol
C.溶液中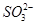 的物质的量浓度基本保持不变
的物质的量浓度基本保持不变
D.溶液中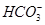 的物质的量浓度减小,
的物质的量浓度减小,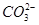 的物质的量浓度增大,但是
的物质的量浓度增大,但是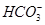 和
和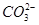 的物质的量浓度之和基本保持不变
的物质的量浓度之和基本保持不变
参考答案:A
本题解析:A项:设混合物中CO2和H2O的物质的量分别为m、n
则44m+18n=11.6①
1mol的CO2和1mol的H2O与Na2O2反应,固体质量分别增加(44-16)=28g、(18-16)=2g
所以28m+2n=3.6②
合并①②
解得m=0.1mol? n=0.4mol
M(平均)=m(总)/n(总)=11.6g/(0.1mol+0.4mol)= 23.2 g/mol。A正确。
B项:2CO2 + 2Na2O2 = 2Na2CO3 + O2①,2Na2O2+2H2O="==4NaOH+" O2↑②,①中转移电子0.1mol,②中转移电子0.4mol,总转移电子书为0.5mol。B错误。
C、D项:剩余固体加入到溶液中,OH-和HCO3-发生反应,OH-+ HCO3-=CO32-+H2O③,溶液中HCO3-浓度减少,CO32-浓度增加来源2个方面,剩余固体Na2CO3中的和反应③的,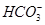 和
和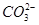 的物质的量浓度之和会增大。
的物质的量浓度之和会增大。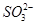 水解方程式为,
水解方程式为,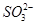 +H20
+H20 HSO32-+OH-④,剩余固体NaOH加入到溶液中会有大量的OH-,反应④会逆向移动,
HSO32-+OH-④,剩余固体NaOH加入到溶液中会有大量的OH-,反应④会逆向移动,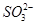 浓度会增大。C、D错误。故选A。
浓度会增大。C、D错误。故选A。
点评:考查的内容不多但繁琐,过氧化钠的性质,水解反应及其移动都是常考的知识点。
本题难度:简单
2、选择题 在某溶液中加入酚酞试液后呈红色,则下列离子在溶液中不能大量存在的是
A.Fe3+
B.Na+
C.Ba2+
D.AlO2-
参考答案:A
本题解析:考点:离子共存问题.
专题:元素及其化合物.
分析:根据能使酚酞变红的溶液,则溶液显碱性,溶液中存在OH-,可以大量共存时离子间不能发生反应.
解答:解:A、Fe3+与OH-结合生成氢氧化铁沉淀,则不能大量共存,故A可选.
B、Na+和OH-不发生反应,能大量共存,故B不可选;
C、Ba2+与OH-不发生反应,能大量共存,故C不可选;
D、AlO2-和OH-不发生反应,能大量共存,故D不可选;
故选A.
点评:本题考查离子共存问题,审题时应注意题中给出的附加条件.
本题难度:困难
3、选择题 某由离子化合物组成的混合物只可能含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、CO32-、SO42-。为确定其组成,准确称取14.82g混合物溶于水得300 mL澄清溶液,分成三等份分别进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液并加热,经碱石灰干燥后收集到标况下气体1.12L
(3)第三份加足量BaCl2溶液,沉淀经洗涤、干燥后称重为6.27g,再向沉淀中加足量盐酸,经过滤、洗涤、干燥后称重为2.33 g
根据上述实验,以下推测不正确的是
A.溶液中c(SO42-)为0.1mol/L、c(CO32-) 为0.2mol/L
B.该混合物中不含Ba2+、Mg2+
C.一定存在NH4+、 K+,无法确定Cl-是否存在
D.实验(3)沉淀中加盐酸后,若只过滤、不洗涤,会对除NH4+外的其他离子含量的测定造成影响
参考答案:A
本题解析:①与AgNO3溶液有沉淀产生的离子有Cl-、CO32-、SO42-;②加足量NaOH溶液加热产生气体,气体是氨气,故一定有铵离子0.04mol;③不溶于盐酸的2.33g为硫酸钡,物质的量是0.01mol;6.27g沉淀是硫酸钡和碳酸钡,碳酸钡质量为6.27g-2.33g=3.94g,物质的量为0.02mol,故一定存在CO32-、SO42-,因而一定没有 Mg2+、Ba2+;c(CO32-)=0.02÷0.1=0.02(mol/L),再根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.04mol;c(-)=2c(CO32-)+2x(SO42-)=0.06mol,故一定有K+,至少0.02mol;综合以上可以得出,一定存在的离子有NH4+、K+、CO32-、SO42-,一定没有的离子Mg2+、Ba2+,可能存在Cl-。故本题选择A选项。
本题难度:一般
4、选择题 在无色溶液中一定能大量共存的离子组是
A.K+、Ca2+、Cl-、SO42-
B.K+、AlO2-、Cl-、CO32-
C.Na+、OH-、MnO4-、HCO3-
D.H+、Fe2+、SO42-、ClO-
参考答案:B
本题解析:分析:根据复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能大量共存.本题还要注意溶液呈无色溶液,不能含有明显有颜色的铜离子、铁离子和亚铁离子等.
解答:A、Ca2+和SO42-形成的硫酸钙是微溶物,浓度大时可以浑浊,所以溶液不一定澄清;故A不符合;
B、K+、AlO2-、Cl-、CO32-离子间不反应,水溶液中可以共存,故B符合;
C、Na+、OH-、MnO4-、HCO3-中MnO4-离子是紫红色溶液,OH-和HCO3-中反应生成水和碳酸根离子,故C不符合;
D、H+、Fe2+、SO42-、ClO- 中Fe2+是浅绿色溶液,H+、Fe2+、ClO- 之间发生氧化还原反应,故D不符合;
故选B.
点评:本题考查了离子性质的应用,主要是有色离子在无色溶液中不存在,离子反应是判断的依据,题目难度中等.
本题难度:困难
5、填空题 现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过分析比较,认为无需检验就可判断其中必有的两种物质是_______和________。(填化学式)
(2)为了确定X,现将(1)中的两种物质记为A和B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕色沉淀,向该沉淀中滴入稀硝酸,沉淀部分溶解,最后留有白色沉淀不再溶解。则:
①X为________?。
A.SO32-?B.SO42-?C.CH3COO-?D.SiO32-?
②A中的化学键类型为____________
③将0.02mol的A与0.01mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为_______(精确到0.1g)。
④利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论___________
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀硫酸,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的________(填相应的离子符号)。有关反应的离子方程式为_____________________
参考答案:(1)Na2CO3;Ba(OH)2?
(2)①?B;②?离子键和共价键;?③?6.1g;④分别取少量D、E溶液于试管中,分别滴加过量的Ba(OH)2溶液,产生白色沉淀的其中含 有Mg2+,先产生白色沉淀,后沉淀又溶解的含有Al3+?
(3)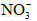 ;
;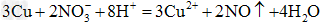
本题解析:
本题难度:一般