微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是
A.稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
B.将固体加入容量瓶中溶解并稀释至刻度,配置成一定物质的量浓度的溶液
C.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
D.从碘水中提取单质碘时,不能用无水乙醇代替CCl4
参考答案:D
本题解析:分析:A.稀释浓硫酸时,应将浓硫酸沿烧杯壁缓慢注入水中,并用玻璃棒不断搅拌;
B.不能在容量瓶内溶解或稀释;
C.配制溶液时,若加水超过容量瓶刻度,应倒掉溶液,洗涤容量瓶,重新配制;
D.乙醇与水互溶,不能萃取碘水中的碘.
解答:A.稀释浓硫酸时,应将浓硫酸沿烧杯壁缓慢注入水中,并用玻璃棒不断搅拌,防止液体溅出伤人,故A错误;
B.不能在容量瓶内溶解或稀释,防止放出大量的热,影响溶液的体积,甚至导致容量瓶破裂的危险,故B错误;
C.配制溶液时,若加水超过容量瓶刻度,溶液是均匀,金属用胶头滴管将多余溶液吸出,溶液的浓度偏低,应倒掉溶液,洗涤容量瓶,重新配制,故C错误;
D.乙醇与水互溶,不能萃取碘水中的碘,从碘水中提取单质碘时,不能用无水乙醇代替CCl4,故D正确;
故选D.
点评:本题考查一定物质的量浓度溶液配制、实验基本操作、萃取等,难度不大,注意基础知识的理解掌握.
本题难度:简单
2、选择题 NA表示阿伏加德罗常数,下列关于7.8g过氧化钠固体的说法正确的是
A.与足量H2O反应,生成O2分子数目为0.1?NA
B.其中所含离子总数目为0.4NA
C.与足量CO2反应,转移的电子数目为0.1?NA
D.其中所含电子总数目为0.4NA
参考答案:C
本题解析:分析:A.根据2Na2O2+2H2O═4NaOH+O2↑反应方程式进行计算解答;
B.过氧化钠晶体是由钠离子和过氧根离子构成,1mol过氧化钠中有3mol离子;
C.根据过氧化钠与二氧化碳反应:2Na2O2+2CO2 =2Na2CO3+O2反应方程式进行分析解答;
D.1个钠离子含有10个电子,一个过氧根离子含有18个电子,据此解答;
解答:过氧化钠的摩尔质量是78g/mol,7.8g过氧化钠就是0.1mol,
A.过氧化钠固体与足量H2O反应,2Na2O2+2H2O═4NaOH+O2↑,根据方程式知2mol过氧化钠与足量水可以得到1mol氧气,即1NA个氧气分子,则0.1molNa2O2充分反应生成O2的物质的量为0.05mol,所以生成O2分子数目为0.05?NA,故A错误;
B.1mol过氧化钠晶体由2mol钠离子和1mol过氧根离子构成,所以1mol过氧化钠中有3mol离子,则0.1molNa2O2有0.3mol离子,故B错误;
C.过氧化钠与二氧化碳反应:2Na2O2+2CO2 =2Na2CO3+O2,氧气来自过氧化钠中的氧,且化合价由-1价变到0价,每生成1mol氧气转移电子的是2mol,即2NA个电子,所以0.1mol过氧化钠就可以和二氧化碳反应转移0.1NA电子,故C正确;
D.1mol过氧化钠晶体中含有2mol钠离子和1mol过氧根离子,1个钠离子含有10个电子,一个过氧根离子含有18个电子,所以1mol过氧化钠晶体中含有38mol电子,则0.1molNa2O2,含电子总数目为3.8NA,故D错误;
故选C.
点评:本题考查有关过氧化钠的物质的量的计算,关键答题时仔细分析微粒间的数量关系,明确过氧化钠结构,题目难度不大.
本题难度:一般
3、选择题 用M表示阿伏加德罗常数的数值,下列说法中一定正确的是
A.1?L?l?mol?L-1的FeCl3溶液中含有NA个Fe3+
B.4.8g镁与足量盐酸反应时,转移0.2?NA个电子
C.钠与水反应生成1.12?L?H2,反应中转移的电子数为0.1NA
D.常温常压下,22g氧气和26g臭氧混合气体所含氧原子总数为3NA
参考答案:D
本题解析:分析:A、三价铁离子水解减小;
B、质量换算物质的量,镁全部反应转移电子数根据反应的镁减少;
C、气体摩尔体积的条件应用;
D、质量换算物质的量,氧气和臭氧都是有氧元素组成,结合分子式计算氧原子数;
解答:A、1?L?l?mol?L-1的FeCl3溶液中含个Fe3+小于NA,故A错误;
B、4.8g镁物质的量为0.2mol,与足量盐酸反应时,转移0.4NA个电子,故B错误;
C、温度和压强未知,钠与水反应生成1.12?L?H2物质的量无法计算,故C错误;
D、22g氧气和26g臭氧混合气体中都是氧原子构成的分子,可以直接计算氧原子物质的量为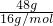 =3mol,故D正确;
=3mol,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的应用,主要考查盐类水解应用,质量换算物质的量计算微粒数,气体摩尔体积的条件应用.
本题难度:困难
4、选择题 对下列物质进行的分类正确的是
A.纯碱、烧碱均属于碱
B.CuSO4?5H2O属于纯净物
C.凡能电离出H+的化合物均属于酸
D.盐类物质一定含有金属阳离子
参考答案:B
本题解析:分析:A、纯碱是碳酸钠,属于盐类;
B、结晶水合物属于纯净物;
C、电离生成的阳离子全部是氢离子的化合物是酸;
D、能电离出金属阳离子(或铵根离子)和酸根离子的化合物是盐.
解答:A、纯碱是碳酸钠,是由金属离子和酸根离子构成的,则不属于碱,属于盐类,故A错误;
B、结晶水合物有固定的组成和性质,属于纯净物,故B正确;
C、电离只生成的阳离子全部是氢离子的化合物才是酸,但硫酸氢钠能完全电离出钠离子、氢离子和硫酸根离子,则属于盐类,故C错误;
D、盐类物质含有的阳离子是金属离子或是铵根离子,故D错误.
故选B.
点评:本题是一道有关物质的分类的题目,熟记各种类型的物质的概念是解题的关键,属于基础知识的考查.
本题难度:困难
5、选择题 用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
C.在常温常压下,11.2LCl2含有的分子数为0.5NA
D.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
参考答案:BD
本题解析:分析:A、氦气为单原子分子.根据n=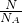 计算氦气物质的量,在根据V=nVm计算体积;
计算氦气物质的量,在根据V=nVm计算体积;
B、根据n= 计算二氧化硫的物质的量,结合二氧化硫的化学式,利用N=nNA计算原子数目;
计算二氧化硫的物质的量,结合二氧化硫的化学式,利用N=nNA计算原子数目;
C、标准状况下气体摩尔体积为22.4L/mol;
D、硝酸镁是强电解质,在溶液中完全电离,由硝酸镁的化学式计算硝酸根离子的浓度,根据n=cV计算硝酸根离子物质的量,利用N=nNA计算硝酸根离子数目.
解答:A、氦气为单原子分子,含有NA个氦原子的氦气的物质的量为1mol,在标准状况下的体积约为22.4L,故A错误;
B、64gSO2中含有的原子数为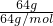 ×3×NAmol-1=3NA,故B正确;
×3×NAmol-1=3NA,故B正确;
C、不是标准状况,气体摩尔体积不一定为22.4L/mol,故C错误;
D、2mol/L的硝酸镁溶液中硝酸根离子浓度为4mol/L,所以1L溶液含有的硝酸根离子数为1L×4mol/L×NAmol-1=4NA,故D正确.
故选BD.
点评:本题考查常用化学计量数的有关计算,难度不大,注意稀有气体为单原子分子,气体摩尔体积使用条件范围,电解质溶液中离子的浓度、数目计算.
本题难度:简单