|
高中化学知识点大全《水的电离平衡》考点强化练习(2017年押题版)(八)
2017-09-24 00:55:49
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于pH=3的盐酸和醋酸溶液的说法正确的是
A.两种溶液中由水电离出来的c(H+)不相同
B.中和相同体积的两种酸溶液所需NaOH的物质的量分别为a和b,则a<b
C.加入足量的铁粉,放出H2的体积相同
D.分别用蒸馏水稀释m倍和n倍,两溶液pH仍相同,则m=n
|
参考答案:B
本题解析:A、两种溶液中由水电离出来的c(H+)相同都是10-3mol·L-1·,错误;B、中和相同体积的两种酸溶液所需NaOH的物质的量分别为a和b,由于醋酸是弱酸,故需要的NaOH的量多,即a<b,正确;C、加入足量的铁粉,没有说明酸的体积,所以放出H2的体积无法判断,错误;D、分别用蒸馏水稀释m倍和n倍,两溶液pH仍相同,由于醋酸是弱酸,加水稀释后又电离,应多加水稀释,即m<n,错误。
考点: 强酸与弱酸比较。
本题难度:一般
2、填空题 (7分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,
用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
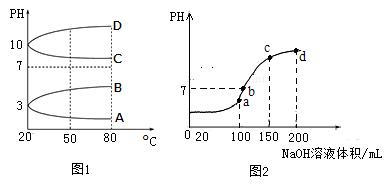
(1)相同条件下,相等物质的量浓度的NH4Al(SO4)2中c(NH4+) (填“=”、“>”“<”)NH4HSO4中c(NH4+)。
(2)如图1是0.1mol?L
参考答案:
本题解析:
本题难度:困难
3、填空题 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl
(1)属于弱电解质的是 ,溶液呈碱性的有 (填序号)。
(2)常温下0.01 mol/L HCl溶液的PH= ;PH=11的CH3COONa溶液中由水电离产生的c(OH-) = 。
(3)用离子方程式表示CH3COONa溶液呈碱性的原因 ,其溶液中离子浓度按由大到小的顺序为 。
(4)将等PH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m n (填“大于、等于、小于”)。
(5)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
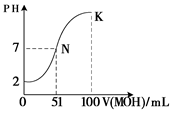
①由图中信息可知HA为_______酸(填“强”或“弱”)。
② K点对应的溶液中,
c(M+)+c(MOH)= mol·L-1。
参考答案:(1)③④、②④⑤
(2) 2 、 10-3 mol/L
(3)CH3COO? + H2O  CH3COOH + OH?、 CH3COOH + OH?、
c(Na+)>c(CH3COO?)>c(OH-)>c(H+)
(4) 小于
(5)① 强 ② 0.01
本题解析:(1)①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl中, CH3COOH 、NH3·H2O属于弱电解质;NaOH、NH3·H2O、CH3COONa 溶液显碱性;(2)常温下0.01 mol/L HCl溶液的PH=-lg0.01=2,PH=11的CH3COONa溶液中的c(H+)=10-11mol/L,CH3COONa为强碱弱酸盐,所以由水电离产生的c(OH-) =Kw/c(H+)=10-3 mol/L ;(3)CH3COONa为强碱弱酸盐,由于醋酸根的水解使得其溶液显碱性,其显碱性的离子方程式为CH3COO? + H2O  CH3COOH + OH?,根据电荷守恒可以得到c(H+)+c(Na+)=c(OH?)+c(CH3COO?),因为溶液显碱性,所以c(OH-)>c(H+),故溶液中离子浓度按由大到小的顺序为c(Na+)>c(CH3COO?)>c(OH-)>c(H+);(4)HCl为强酸,而醋酸为弱酸,所以将等PH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m小于n;(5)由图可以知道, 0.01 mol·L-1HA溶液pH为2,所以HA为强酸;② K点对应的溶液中,根据物料守恒可以知道加入的MOH的物质的量为0.02×0.1=0.002mol,所以c(M+)+c(MOH)=0.002/0.2=0.01mol·L-1。 CH3COOH + OH?,根据电荷守恒可以得到c(H+)+c(Na+)=c(OH?)+c(CH3COO?),因为溶液显碱性,所以c(OH-)>c(H+),故溶液中离子浓度按由大到小的顺序为c(Na+)>c(CH3COO?)>c(OH-)>c(H+);(4)HCl为强酸,而醋酸为弱酸,所以将等PH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m小于n;(5)由图可以知道, 0.01 mol·L-1HA溶液pH为2,所以HA为强酸;② K点对应的溶液中,根据物料守恒可以知道加入的MOH的物质的量为0.02×0.1=0.002mol,所以c(M+)+c(MOH)=0.002/0.2=0.01mol·L-1。
考点:强弱电解质、盐类水解、电荷守恒,物料守恒
点评:本题考查了强弱电解质、盐类水解、电荷守恒,物料守恒的相关知识,有一定的综合性,本题难度适中。
本题难度:一般
4、选择题 常温下,某溶液中由水电离的c(H+)=1×10-13mol·L-1,该溶液可能是
[? ]
①二氧化硫水溶液 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④
B.①②
C.②③
D.③④
参考答案:A
本题解析:
本题难度:一般
5、选择题 下列说法正确的是( )
A.0.1mol?L-1Na2HPO4溶液中:c(Na+)+c(H+)=2c(HPO42-)+c(OH-)
B.25℃时,某溶液中由水电离出的c(H+)=l×10-amol?L-1,若a>7,则该溶液的pH为a或14-a
C.在一定温度下,将pH都等于3的醋酸与盐酸等体积混合,所得溶液pH>3
D.用惰性电极电解CuSO4溶液至CuSO4完全反应,继续电解一段时间后,只要加入Cu(OH)2就能恢复至原浓度
参考答案:D
本题解析:
本题难度:一般
|