微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 Ⅰ:元素的金属活动性递变规律是元素周期表学习的重要内容之一.某校研究性学习小组查阅课外资料,看到第IVA族的三种金属锗、锡、铅的性质:“锗、锡在空气中不反应,铅在空气中表面生成一层氧化铅,请解释发生上述变化的原因是______.
Ⅱ:另一研究性学习小组欲通过实验探究Zn、Fe、Cu的金属活动性顺序,根据不同的实验条件设计了如下的几种实验方案:
(1)该小组同学根据提供的Zn片、Fe片和稀硫酸,设计成了一个原电池比较锌与铁的活动性顺序,请在右侧方框内画出原电池装置图.
并写出正极的反应现象及电极反应式.
现象______;电极反应式______.
(2)现只有Fe片、CuO和稀硫酸这几种药品,请你帮忙设计方案比较铁与铜的活动性顺序.你的设计方法是______.
参考答案:Ⅰ:金属越活泼,在空气中越容易发生反应,同主族自上而下,金属性随着原子序数的增大而增强,铅的原子序数最大,所以铅的金属性比锗和锡都强,故易被空气中的氧气氧化成氧化铅.
故答案为:铅的活动性比锗和锡都强,易被空气中的氧气氧化.
Ⅱ:(1)原电池中较活泼的金属作负极,较不活泼的金属作正极,锌的活泼性大于铁,所以铁作正极,反应时,电子从负极沿导线流向正极,溶液中的氢离子在正极上得电子生成氢气,所以在正极上看到有气泡生成,电极反应式为2H++2e-=H2↑.
故答案为:表面有气泡产生,2H++2e-=H2↑,该装置图为
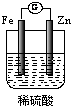
.
(2)根据提供的药品知,铁和氧化铜都和稀硫酸反应,如果用铁和硫酸铜反应时,铁表面有红色的铜生成,就说明铁的金属性大于铜的;如果铁表面没有生成红色的铜,就说明铁的金属性小于铜的.
故答案为:先用氧化铜与稀硫酸反应生成硫酸铜,再将铁片插入硫酸铜溶液中置换出铜.
本题解析:
本题难度:一般
2、选择题 A、B都是短周期元素,原子序数:B>A,它们可以形成化合物A2B.由此可得出的正确判断是
[? ]
A.A、B肯定不在同一周期
B.A在B的前一周期
C.A肯定是金属元素
D.以上说法均不正确
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列表述正确的是( )
A.原子核内有8个中子的碳原子:
C
B.1H2和2H2互为同位素
C.O中,质量数之和是质子数之和的两倍
D.硫原子的结构示意图:
参考答案:A、原子核内有8个中子的碳原子,质量数=14,碳原子为146C,故A错误;
B、具有质子数相同,中子数不同的同种元素的不同原子互称同位素,1H和2H互为同位素,故B错误;
C、D216O分子中质量数之和=20,质子数之和10,质量数之和是质子数之和的两倍,故C正确;
D、硫原子的结构示意图 ,故D错误;
,故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻.X 的核电荷数是Y的核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是
[? ]
A.还原性:X的氢化物>Y的氢化物>Z的氢化物
B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C.YX2、M2Y都是含有极性键的极性分子
D.Z元素的最高价氧化物的水化物的化学式为HZO4
参考答案:D
本题解析:
本题难度:一般
5、选择题 根据元素在周期表中的位置判断,下列叙述正确的是
A.金属性强弱:Rb>Ca>Al
B.阴离子还原性:O2->S2->Se2-
C.氢化物的稳定性:PH3>H2S>HCl
D.酸性强弱:H2SO4>H3PO4>HClO4
参考答案:A
本题解析:O、S、Se是同一主族的元素,单质氧化性逐渐减弱,相应阴离子还原性逐渐增强,即还原性O2-<S2-<Se2-,B项错.P、S、Cl处于同一周期,气态氢化物稳定性逐渐增强,PH3<H2S<HCl,最高价氧化物水化物的酸性逐渐增强,H3PO4<H2SO4<HClO4,C、D两项错.
本题难度:一般