微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 依据元素周期表及元素周期律,下列推断正确的是( )
A.H3BO3酸性比H2CO3强
B.若M+和R2-核外电子层结构相同,则原子序数:R>M
C.Mg(OH)2的碱性比Be(OH)2的强
D.HCl、HBr、HI的热稳定性依次增强
参考答案:A.因非金属性C>B,则最高价氧化物的水化物的酸性为H3BO3酸性比H2CO3弱,故A错误;
B.电子层结构相同,则M的原子序数-1=R的原子序数+1,则原子序数为R<M,故B错误;
C.金属性Mg>Be,则最高价氧化物的水化物的碱性为Mg(OH)2的碱性比Be(OH)2的强,故C正确;
D.非金属性Cl>Br>I,则气态氢化物的稳定性为HCl、HBr、HI的热稳定性依次减弱,故D错误;
故选C.
本题解析:
本题难度:一般
2、简答题 I.如图是由Emil?Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题:

(1)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式______.
(2)Fe的周期位置______
(3)用电子式表示元素a、g形成化合物的形成过程______;
(4)写出b元素的氢化物与b元素的最高价氧化物对应水化物反应的化学方程式______
(5)d的最高价氧化物对应的水化物与f的单质反应的离子方程式______.
(6)a元素与碳元素形成分子的空间结构可能是(填序号)______.

(7)请设计实验比较e?f?的金属性强弱(要求有操作、现象、结论)______.
(8)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和某气体,若沉淀和气体的物质的量之比为2:1,反应的离子方程式为______.
参考答案:(1)把H放在第ⅦA族,则H元素的最低化合价为-1价,则NaH为离子化合物,电子式为Na+[:H]-,故答案为:Na+[:H]-;
(2)铁元素在第四周期,在周期表中的第8列,即第四周期第VIII族,故答案为:第四周期第VIII族;
(3)硫化氢是由硫原子和氢原子间通过共用电子对形成的共价化合物,其形成过程表示为
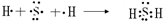
,故答案为:
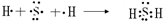
;
(4)由周期表可知,b为N元素,b元素的氢化物氨气与其最高价氧化物的水化物硝酸可生成一种盐为硝酸铵,即NH3+HNO3═NH4NO3,故答案为:NH3+HNO3═NH4NO3;
(5)d的最高价氧化物氢氧化钠和f的单质铝反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)碳原子和氢原子之间形成的化合物甲烷是正四面体结构,苯是平面六边形结构,故答案为:cd;
(7)比较镁和铝金属活泼性强弱的方法:取大小相等的镁条和铝条,加入到相同浓度的盐酸中,观察产生氢气的快慢,最先产生氢气的金属活泼性强,反之活泼性弱,故答案为:取大小相等的镁条和铝条,加入到相同浓度的盐酸中,观察产生氢气的快慢,最先产生氢气的金属活泼性强,反之活泼性弱;
(8)d为钠,d的某化合物呈淡黄色,则该化合物为过氧化钠,具有氧化性,沉淀和气体的物质的量之比为2:1,发生的反应为3Na2O2+4H2O+2Fe2+═2Fe(OH)3+O2↑+6Na++2OH-,
故答案为:3Na2O2+4H2O+2Fe2+═2Fe(OH)3+O2↑+6Na++2OH-.
本题解析:
本题难度:一般
3、选择题 下表为元素周期表中短周期的一部分。下列有关A、B、C、D、E五种元素的叙述中,不正确的是
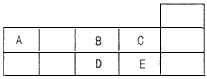
[? ]
A.D在过量的B中燃烧的主要产物为
B.C的氢化物的沸点比E的氢化物的沸点高
C.A与B形成的阴离子可能有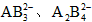
D.由这五种元素中的几种形成的只含极性键的非极性分子不少于4种
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列说法中正确的是( )
A.元素周期表中元素排序的依据是元素的相对原子质量
B.元素周期表中元素排序的依据是原子的核电荷数
C.元素周期表有十六个纵行,也就是十六个族
D.元素周期表已发展成为一个稳定的形式,它不可能再有任何新的变化了
参考答案:A、元素周期表中元素排序的依据是原子的核电荷数,故A错误;
B、元素周期表中元素排序的依据是原子的核电荷数,故B正确;
C、元素周期表有十八个纵行,十六个族,故C错误;
D、元素周期表中元素的种数还要增多,仍不稳定,故D错误.
故选B.
本题解析:
本题难度:简单
5、选择题 下列说法错误的是( )
A.在C(s)+H2O(g)

CO(g)+H2(g)反应体系中,增加碳的量不能迅速提高正反应速率
B.钾的金属性比钠强,所以钾与水的反应比钠的反应剧烈
C.在压强相同条件下,结构相似的CH4、SiH4、GeH4的沸点依次升高,所以结构相似的HF、HCl、HBr、HI的沸点也依次升高
D.面粉厂严禁烟火的原因是面粉粉尘表面积大,与空气接触遇明火极易发生爆炸
参考答案:A、在化学反应中,固体量的增减不会引起化学反应速率的改变,故A正确;
B、第ⅠA族中钾的金属性比钠强,金属性越强,金属和水反应置换氢气的速率越快,反应越剧烈,所以钾与水的反应比钠的反应剧烈,故B正确;
C、分子晶体的分子量越大,一般是沸点越高,但是在HF分子间含有氢键,所以HF分子沸点反常的高,故C错误;
D、面粉加工厂周围存在大量的面粉粉尘,当其扩散在空气中与空气充分接触,极容易发生爆炸,所以宜贴上“严禁烟火”的标语,故D正确.
故选C.
本题解析:
本题难度:简单