微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在金刚石的网状结构中,含有共价键形成的碳原子环,其中最小的环上,碳原子数是
A.2个
B.3个
C.4个
D.6个
参考答案:D
本题解析:从金刚石的空间网状结构图中可以看出,最小的环上有6个碳原子。
本题难度:简单
2、选择题 下列物质在固态时是由原子直接构成的是( )
A.二氧化硫(SO2)
B.二氧化碳(CO2)
C.二氧化硅(SiO2)
D.二氧化氮(NO2)
参考答案:C
本题解析:二氧化硅(SiO2)是原子晶体,由硅原子和氧原子直接构成,A、B、D是分子晶体,由分子直接构成。
本题难度:一般
3、填空题 1)构成分子晶体的粒子是__________,这类粒子间的作用力一定有__________,还可能有__________。如果分子间作用力只是__________,若以一个分子为中心,其周围通常可以有__________个紧邻的分子,分子晶体的这一特征称为__________。干冰中CO2分子采取的就是这样的堆积方式。若分子内存在吸引电子能力较强、半径较小的__________原子与H原子所形成的共价键,则会形成氢键,氢键不仅具有饱和性,也具有__________。能形成氢键的物质较多,如______________________________等。在冰中,每个水分子与相邻的__________个水分子形成氢键,呈__________立体结构。
(2)在原子晶体中,所有原子都以__________键结合,整个原子晶体是一个三维的__________结构。在金刚石中,C原子采取__________杂化方式,每个C原子与另外__________个C原子以共价键相结合,键角为__________,晶体中最小碳环由__________个C原子构成,且不在同一个平面内。晶体硅的结构与金刚石类似,SiO2的晶体结构可以看作是在晶体硅的Si—Si键之间插入__________原子而形成的,在12 g SiO2晶体中含有化学键的物质的量为 __________mol。
参考答案:(1)分子 范德华力 氢键 范德华力12 分子密堆积 N、O、F 方向性 HF、NH3、H2O、CH3OH等 4 正四面体
(2)共价 共价网状 sp3 4 109°28′ 6 氧 0.8
本题解析:本题考查了分子密堆积和氢键,以及典型的分子晶体和原子晶体的结构。在SiO2晶体中每一个硅原子都与周围的四个氧原子形成了四个硅氧键,并且不存在共用的情况,所以SiO2晶体中化学键的数目为硅原子数目的四倍。12 g SiO2晶体的物质的量是0.2 mol,所以化学键的物质的量为0.8 mol。
本题难度:简单
4、选择题 某晶体的部分结构为正三棱柱(如下图所示),这种晶体中A、B、C三种微粒数目之比为
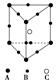
A.3∶9∶4 ? ? B.1∶4∶2?C.2∶9∶4? D.3∶8∶4
参考答案:B
本题解析:A位于正三棱柱的顶角,则有1/12 的A属于该晶胞,该晶胞中含A的个数为6×(1/12)=1/2,B分为两类,位于侧棱上的B有1/6属于该晶胞,位于上下底面边上的B有1/4属于该晶胞,该晶胞含B原子个数为3×1/6+6×1/4=2,含C原子个数为1,则A、B、C三种原子个数之比为1/2∶2∶1=1∶4∶2。故选B。
点评:本题考查了根据晶胞结构确定化学式,难度不大,利用均摊法即可分析解答本题。
本题难度:一般
5、填空题 (15分)氮化硅是一种重要的结构陶瓷材料,硬度大、耐磨损。利用SiO2和C的混合粉末在N2的气氛中加热至1300℃反应制得。请回答下列问题:
(1)已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,则氮化硅的化学式____,晶体类型是?;
(2)基态Si原子的电子排布式为_________;Si和C相比,电负性较大的是_________,
(3)在SiO2晶体结构中,O-Si-O的键角是_______,Si原子和周围的四个O原子组成的空间构型为?,SiO2中Si的杂化类型_______;
(4)氮化硅抗腐蚀能力强,一般不与其他无机酸反应,但能和氢氟酸反应生成硅酸。试写出该反应的化学方程式?。
(5)晶体硅的晶胞如图所示,则每个晶体硅的晶胞中含有?个硅原子。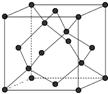
参考答案:(1) Si3N4 (2分)原子晶体(1分) (2) 1s22s22p63s22p2 ?(2分) C (1分)
(3) 109°28′(1分)?正四面体(2分)sp3(2分)?
(4) Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F(2分)? (5)? 8(2分)
本题解析:(1)每个原子都满足8电子稳定结构,所以其化合价分别是+4价和-3价,因此化学式为Si3N4。由于晶体中的微粒是原子,所以形成的晶体是原子晶体。
(2)根据构造原理可知,基态Si原子的电子排布式为 1s22s22p63s22p2 。非金属性越强,电负性越大,所以碳的电负性大于硅的。
(3)由于在SiO2晶体结构中,Si原子和周围的四个O原子相邻,所以构成的应是正四面体,采用的是sp3杂化,O-Si-O的键角是 109°28′。
(4)能和氢氟酸反应生成硅酸,则根据原子守恒可知,另外一种生成物是NH4F,所以方程式为Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F。
(5)根据晶体硅的晶胞结构可知,8个顶点有8个硅原子,6个面心处有6个硅原子,晶胞内部还有4个硅原子,所以共计是8×1/8+6×1/2+4=8个。
本题难度:一般