微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下列关系中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸。当X无论是强酸还是强碱都有如下转化关系:

当X是强酸时,A、B、C、D、E均含有同一种元素;当X是强碱时,A、B、C、D、E均同时含有另一种元素。
回答下列问题:
(1)A是?,Y是?,Z是?;
(2)当X是强碱时,E是?;
(3)当X是强酸时,E是?;
(4)写出A与X反应的离子方程式?。
参考答案:(1)A为(NH4)2S,Y为O2,Z是H2O;
(2)E是HNO3;
(3)E是H2SO4;
(4)NH4++OH-=NH3↑+H2O,S2-+2H+=H2S↑。
本题解析:
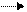
 此类题的解答一般有以下步骤:思维起点的选择:思维起点是指开始时的思维指向、思维对象或思维角度,推断题中的思维起点应是最具特征的某个条件(包括文字叙述或某个变化过程);思维过程的展开:解题者在确定思维起点的基础上,利用题目所给信息,结合已有的化学知识和解题经验,不断地缩小问题状态与目标状态的距离;思维过程的检验:将上述思维过程的结果代入题中,检查一下是否符合题中条件。本题中C? D的变化和D的相对分子质量比C的大16是题中一个最具有特征的条件,通过分析可初步判断D比C多一个氧原子。联想已构建的中学化学知识网络,符合这种转化关系的有:SO2? SO3,NO? NO2,Na2SO3? Na2SO4等。由此可出推断Y为O2,由于E为酸,则D应为能转化为酸的某物质,很可能为SO3、NO2等。若D为SO3,顺推E为H2SO4,Z为H2O,逆推B为H2S,A为硫化物,此时X为强酸;若D为NO2,顺推E为HNO3,Z为H2O,逆推B为NH3,A为铵盐。综合而得A应为(NH4)2S。
此类题的解答一般有以下步骤:思维起点的选择:思维起点是指开始时的思维指向、思维对象或思维角度,推断题中的思维起点应是最具特征的某个条件(包括文字叙述或某个变化过程);思维过程的展开:解题者在确定思维起点的基础上,利用题目所给信息,结合已有的化学知识和解题经验,不断地缩小问题状态与目标状态的距离;思维过程的检验:将上述思维过程的结果代入题中,检查一下是否符合题中条件。本题中C? D的变化和D的相对分子质量比C的大16是题中一个最具有特征的条件,通过分析可初步判断D比C多一个氧原子。联想已构建的中学化学知识网络,符合这种转化关系的有:SO2? SO3,NO? NO2,Na2SO3? Na2SO4等。由此可出推断Y为O2,由于E为酸,则D应为能转化为酸的某物质,很可能为SO3、NO2等。若D为SO3,顺推E为H2SO4,Z为H2O,逆推B为H2S,A为硫化物,此时X为强酸;若D为NO2,顺推E为HNO3,Z为H2O,逆推B为NH3,A为铵盐。综合而得A应为(NH4)2S。
本题难度:一般
2、填空题 Ⅰ(4分)(1)写出表示含有8个质子、10个中子的原子的化学符号?。
(2)元素周期表中,所含元素超过18种的周期是?。
Ⅱ(6分)有:① 168O、178O、188O ②H2O、D2O ③石墨、金刚石④H、D、T 四组微粒或物质,回答下列问题:
(1)互为同位素的是___________;?(2)互为同素异形体的是_______________;
(3)由①和④中微粒能结合成含三个原子的化合物,这些化合物中分子量最大的是_____________(填化学式)。
参考答案:(1) 188O? (2)第六、七周期
Ⅱ(1)①④(2)③(3)31T2188O
本题解析:写出表示含有8个质子、10个中子的原子的化学符号188O,元素周期表中,所含元素超过18种的周期是第六、七周期,有镧系、锕系。分子量最大的是31T2188O。
本题难度:一般
3、选择题 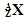 与
与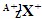 的两种微粒,下列叙述正确的是( )
的两种微粒,下列叙述正确的是( )
A.一定都是由质子、中子、电子组成的
B.化学性质几乎完全相同
C.核电荷数和核外电子数一定相等
D.质子数一定相同,质量数和中子数一定不相同
参考答案:D
本题解析:考查原子的组成及表示方法。在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,所以选项D是正确的。A不正确,例如氕原子木中子。二者核外电子数不同,所以化学性质不同,B、C都不正确。答案选D。
本题难度:简单
4、填空题 (12分)现有6种短周期元素的性质或原子结构如下表:
元素编号
| 元素性质或原子结构
|
W
| 周期表中原子半径最小的元素
|
U
| 地壳中含量最多的金属元素
|
R
| 单质为空气的主要成分之一
|
T
| M层上有6个电子
|
X
| 最外层电子数是次外层电子数的2倍
|
Y
| 氢化物水溶液呈碱性
|
Z
| 元素最高正价是+7价
|
完成下列空白(涉及W、U、R、T、X、Y、Z时,用元素符号表示):
小题1:元素T的原子共有?个电子;元素X的一种核素可测定文物年代,这种核素的
符号是?。
小题2:用电子式表示:
①气态化合物XR2_________________;
②元素W、R形成的10电子分子的形成过程______________________________。
小题3:元素Z与元素T相比,非金属性较强的是?,下列表述中能证明这一事实的
是?(填序号)。
a. 常温下Z的单质和T的单质状态不同
b. Z的氢化物比T的氢化物稳定
c. 一定条件下Z和T的单质都能与氢氧化钠溶液反应
参考答案:
小题1:16?14C?
小题2: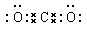 ?
?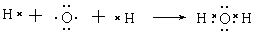
小题3: Cl? b
本题解析:考查原子核外电子的排布规律以及元素周期律的应用。周期表中原子半径最小的元素是H,则W是H。地壳中含量最多的金属元素是氧,则U是O。单质为空气的主要成分之一,则R是N。M层上有6个电子的元素是硫,则T是S。最外层电子数是次外层电子数的2倍的元素是碳,则X是C。氢化物水溶液呈碱性是氨气,则Y是N。元素最高正价是+7价短周期元素是Cl,则Z是Cl。
小题1:质子数等于核电荷数等于核外电子数,测定文物年代的是14C。
小题2:化合物XR2是CO2,形成的化学键是极性键,形成的化合物是共价化合物。W、R形成的10电子分子是水,含有的化学键是极性键。
小题3:比较非金属性强弱时可以元素周期律,也可以利于最高价氧化物的水化物的酸性强弱,或者是非金属单质和氢气化合的难易程度以及相应氢化物的稳定性,或者是非金属之间的相互置换能力等。
本题难度:一般
5、选择题 下列叙述中正确的是?(?)
A.Na原子失电子能力比Mg原子强
B.氟的氢化物不稳定
C.H2SO4比H3PO4酸性弱
D.Mg(OH)2比Ba(OH)2的碱性强
参考答案:A
本题解析:Na比Mg活泼所以Na原子失电子能力比Mg原子强,F是最强的非金属所以HF的稳定性最强,S的非金属性强于P所以H2SO4比H3PO4酸性强,Mg的金属性比Ba弱所以Mg(OH)2比Ba(OH)2的碱性弱。答案选A。
点评:本题依据元素周期律进行判断,非常简单基础。
本题难度:一般