|
高中化学知识点归纳《键参数——键能、键长与键角》考点巩固(2017年最新版)(六)
2017-09-24 01:06:16
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化学用语正确的是
[? ]
A.HCl的电子式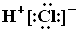
B.Cl-的结构示意图
C.CO2的电子式
D.质量数为37的氯原子1737Cl
参考答案:B
本题解析:
本题难度:简单
2、简答题 已知:下列关系正确的是( )
A.Q1+Q2>Q3
B.Q1+Q2>2Q3
C.Q1+Q2<Q3
D.Q1+Q2<2Q3
| 
参考答案:反应热△H=反应物总键能-生成物总键能,
对于H2(g)+Cl2(g)=2HCl(g)的反应热△H=Q1+Q2-2Q3
由于H2(g)+Cl2(g)=2HCl(g)是放热反应,△H<0,
所以Q1+Q2-2Q3<0,即Q1+Q2<2Q3
故选D.
本题解析:
本题难度:一般
3、填空题 钾、镁、氟、硼等元素在每升海水中的含量都大于1毫克,属于海水中的常量元素。
(1)钾、镁、氟、硼电负性从大到小的排列顺序是?。
(2)镓与硼同主族,写出镓元素原子的价电子排布式(即外围电子排布式):?。
(3)用价层电子对互斥模型推断BF3和NF3的空间构型分别为?、?。
(4)钾、镁、氟形成的某化合物的晶体结构为K+在立方晶胞的中心,Mg2+在晶胞的8个顶角,F-处于晶胞的棱边中心。由钾、镁、氟形成的该化合物的化学式为?,每个K+与?个F-配位。
参考答案:(1)F>B>Mg>K
(2)4s24p1
(3)平面三角形 三角锥形
(4)KMgF3 12
本题解析:(1)同周期中,随着原子序数的递增,元素电负性增大;同主族中,随着原子序数的递增,元素电负性减小,而且一般情况下,非金属元素的电负性大于金属元素的电负性。
(2)镓为31号元素,位于第四周期,与B同主族,故最外层有3个电子,即价电子排布式为4s24p1。
(3)BF3的中心原子只有3个价电子,与3个F原子提供的3个电子形成3对成键电子,而NF3的中心原子N有5个价电子,与3个F原子提供的3个电子形成3对成键电子,还有1对孤电子对,故前者为平面三角形,后者为三角锥形。
(4)晶胞中的K+为1个,Mg2+为8×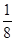 =1个,F-为12× =1个,F-为12×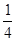 =3个,故钾、镁、氟形成的某化合物的化学式为KMgF3;晶胞12条棱上的12个F-与处于晶胞中心的K+等距离,所以每个K+与12个F-配位。 =3个,故钾、镁、氟形成的某化合物的化学式为KMgF3;晶胞12条棱上的12个F-与处于晶胞中心的K+等距离,所以每个K+与12个F-配位。
本题难度:一般
4、填空题 (8分) 已知A、B、C、D、E 和F这6种分子所含原子数目依次为1、2、3、4、6、6,且都含有18个电子。又知B、C、 D和F是由两种元素的原子组成。请回答:
(1)B和C的分子式分别是?和?;C分子的立体结构呈?形,该分子属于?分子(填“极性”或“非极性”);
(2)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是?,结合该物质的性质,推测D分子的极性?(填“极性”或“非极性”);
(3)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是??。
(4)我国神州8号使用的燃料就有F,F完全燃烧,生成一种空气中主要气体和另外一种常见液体。试写出F在纯氧中燃烧的化学方程式。
参考答案:(1) HCl?H2S?V?极形? (2)H2O2?极形
(3)CH4O? (4) N2H4 ?+O2 ="====" N2 + 2H2O
本题解析:略
本题难度:一般
5、选择题 下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是( )
A.基态原子的N层上只有一个电子的元素,一定是ⅠA族元素
B.原子的价电子排布为(n-1)d6-8ns2的元素一定是副族元素
C.基态原子的P能级上半充满的元素一定位于p区
D.基态原子的价电子排布为(n-1)dxnsy的元素的族序数一定为x+y
参考答案:A.基态原子的N层上只有一个电子的元素,可能为K、Cr或Cu,K为主族元素,Cr、Cu为副族元素,故A错误;
B.副族元素的d能级电子数为10或1~5,原子的价电子排布为(n-1)d6-8ns2的元素为Ⅷ族元素,故B错误;
C.基态原子的p能级上半充满的元素,电子最后填充p能级,属于p区,故C正确;
D.为ⅢB~ⅦB及Ⅷ族元素,其族序数为外围电子中d、s能级含有电子数目之和,族序数一定为x+y,为ⅠB族、ⅡB族元素,族序数等于外围电子排布中s能级中的电子数为y,故D错误,
故选:C.
本题解析:
本题难度:一般
| 