微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知反应A2(g)+2B2(g)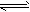 2AB2(g)的△H<0,下列说法正确的是
2AB2(g)的△H<0,下列说法正确的是
[? ]
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
2、填空题 ?T?℃时,将3mol气体A和1mol气体B通入体积为2L的密闭容器内(容积不变),发生反应:3A(g)+B(g) xC(g)?,2min时反应达到平衡状态(温度不变),剩余0.8molB。并测得C的浓度为0.4?mol?/?L.请回答下列问题:
xC(g)?,2min时反应达到平衡状态(温度不变),剩余0.8molB。并测得C的浓度为0.4?mol?/?L.请回答下列问题:
(1)从开始反应至平衡状态,生成C的平均反应速率为___,A的转化率为____.
(2)X=__________
(3)若继续向原平衡状态的混合物容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡将_______(填字母,下同),若通入气体A后,化学平衡将______。
a.向正反应方向移动 b.向逆反应方向移动 c.不移动
(4)?T?℃时,向2L密闭容器中充入4molC,反应达到平衡时,B的物质的量为______。
3、选择题 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A?(g)+xB(g)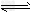 2C(g), 达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示。下列说法中正确是
2C(g), 达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示。下列说法中正确是
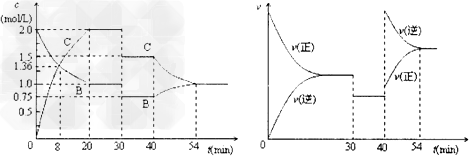
[? ]
A.8min时表示正反应速率等于逆反应速率
B.前20min?A的反应速率为1.00mol/(L·min?)
C.反应方程式中的x=1,30min时表示增大压强
D.40min时改变的条件是升高温度,且正反应为放热反应
4、填空题 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知:
2CO(g)+O2(g)=2CO2(g)?△H=-566kJ/mol?
2Fe(s)+3/2O2(g)=Fe2O3(s)?△H=-825.5?kJ/mol
反应:Fe2O3(s)+3CO(g)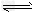 2Fe(s)+3CO2(g)?△H=_______kJ/mol。
2Fe(s)+3CO2(g)?△H=_______kJ/mol。
II.反应?1/3Fe2O3(s)+CO(g)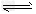 2/3?Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡。
2/3?Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡。
(1)CO的平衡转化率=?_____________。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度?b.增大反应体系的压强 c.选取合适的催化剂?
d.及时吸收或移出部分CO2? e.粉碎矿石,使其与平衡混合气体充分接触
III.(1)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
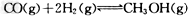 ?。请根据图示回答下列问题:
?。请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率?(H2)=?________。
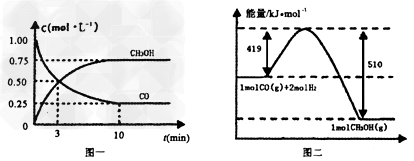
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表
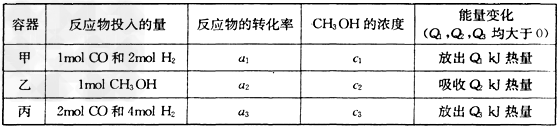
则下列关系正确的是________。
A.c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1?+a2?=1
E.该反应若生成1mol?CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l?molCO、2mol?H2和1mol?CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动。
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式__________________。
5、填空题 某反应的平衡常数表达式为 ,恒容时,温度升高.H2浓度减小。分析下列问题:
,恒容时,温度升高.H2浓度减小。分析下列问题:
(1)该反应的化学方程式为:____________。
(2)温度升高,该反应的K值______________(填“增大”“减小”或“不变”),化学平衡移动后达到新的平衡,CO2和CO体积比_______________(填“增大”“减小”或“不变”)。
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生反应,CO和H2O浓度变化如下图,则 0-4min的平均反应速率v(CO)=______ mol/(L·min),850℃的化学平衡常数的值K= __________。
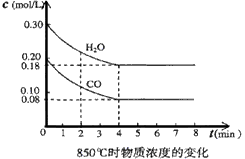
(4)850℃时,在相同容器中发生反应CO2+ H2 CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、 二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时 v(正) ______v(逆)(“大于”“ 小于”“等于”)。
CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、 二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时 v(正) ______v(逆)(“大于”“ 小于”“等于”)。