微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为(?)
A.1:3
B.4 :3
:3
C.2:1
D.3:1
参考答案:B
本题解析:略
本题难度:简单
2、填空题 实验室可用KMnO4固体和浓盐酸反应制氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O。
(1)该反应中氧化剂是_____________,还原剂是__________________。
(2)若反应中有0.20 mol 电子发生转移,生成氯气的体积为?(标准状况),被氧化的HCl的物质的量是?。
参考答案:(1) KMnO4 ,? HCl?;(2)2.24L? , 0.20 mol。
本题解析:在反应2KMnO4+16HCl(浓) ="==" 2KCl+2MnCl2+5Cl2↑+8H2O中,化合价的变化: Mn由KMnO4中的+7价——MnCl2是+2价,化合价降低,得到电子,被还原,发生还原反应,作氧化剂;Cl由HCl的-1价——Cl2的0价,化合价升高,失去电子,被氧化,反应氧化反应,作还原剂。产生5molCl2,转移电子10mol。若转移电子0.20mol,则产生氯气为0.1mol,在标准状况下体积为2.24L。这时被氧化的HCl的物质的量为0.20mol。
本题难度:一般
3、选择题 关注饮用水,保证人民的生活质量。回答下列两个问题:
(1)饮用水中的NO3-?对人类健康会产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
①上述反应中的氧化剂为?。
②上述反应中若生成标况下3.36LN2,则转移的电子数为?。
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上制取氯气的化学反应方程式为?。
②漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,反应的离子方程式为?。
参考答案:①? NaNO3?②? 1.5NA或9.03? ×1023③2NaCl+2? H2O=Cl2? ↑+H2? ↑+2NaOH?
④? Ca2++2? ClO-+CO2+H2O=CaCO3↓+2? HClO
本题解析:(1)①反应物中NaNO3到产物中N2,N的价态由+5价变为0价。化合价降低,做氧
化剂。②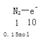 可以求出电子数为1.5NA
可以求出电子数为1.5NA
(2)①2NaCl+2? H2O=Cl2? ↑+H2? ↑+2NaOH
②Ca2++2? ClO-+CO2+H2O=CaCO3↓+2? HclO
本题难度:一般
4、选择题 向含有Fe2+、I-、Br-的溶液中缓慢通入氯气,溶液中各种离子的物质的量变化如图所示。
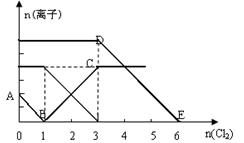
下列说法正确的是
A.B点时溶液中含有I-和Br-
B.DE段表示n (F e2+)的变化情况
e2+)的变化情况
C.原溶液中n (Fe2+) :n (I-) :n (Br-) =" 3" :1 :2
D.当通入2mol Cl2时,溶液中发生的离子反应是:2Fe2+ + 2I- + 2Cl2 = 2Fe3+ + I2 + 4 Cl-
参考答案:D
本题解析:略
本题难度:一般
5、选择题 将7.28gFe溶于过量的稀H2SO4中,在加热的条件下,用2.02gKNO3去氧化溶液中Fe2+,待反应完全后,剩余Fe2+还需0.4mol/LKMnO4溶液25mL才能完全氧化,已知其反应方程式为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O。则KNO3的还原产物是?
A.N2O
B.NO
C.NO2
D.N2O3
参考答案:A
本题解析:7.28gFe溶于过量的稀H2SO4中得到n(Fe2+)为0.13mol。加入KNO3和KMnO4后,NO3-和MnO4-将Fe2+氧化成Fe3+,设KNO3的还原产物中N的化合价为x,则失电子总数为0.13mol,得电子总数为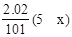 +0.4mol×0.025L×5=0.13,所以x=1,所以还原产物为N2O。答案选A。
+0.4mol×0.025L×5=0.13,所以x=1,所以还原产物为N2O。答案选A。
点评:本题根据得失电子数相等计算简单。
本题难度:一般