微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 问题提出:小王同学有次实验时把SO2通入装有BaCl2、FeCl3的混合溶液的试管中,出现了白色浑浊物.
假设、验证:
| 假设 | 实验验证方法及现象
假设1
白色浑浊物是BaSO3.
(1)______
假设2
(2)白色浑浊物是BaSO4,主要
原因是______
.
反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中,不出现浑浊.滴加FeCl3溶液后出现浑浊
(3)通入纯净的CO2的目的______
|
请把上表填充完全.
(4)写出SO2通入BaCl2、FeCl3的混合溶液生成沉淀相关的离子方程式.______.
参考答案:(1)亚硫酸钡是能溶于盐酸的白色沉淀,硝酸能将其氧化为硫酸钡白色沉淀,所以可以在白色浑浊物中加入过量盐酸,看是否变澄清,
故答案为:在白色浑浊物中加入过量盐酸,会变澄清;
(2)Fe3+氧化了水中的SO2,产生硫酸根离子,在Ba2+作用下,生成BaSO4沉淀,故答案为:Fe3+氧化了水中的SO2,在Ba2+作用下,生成BaSO4;
(3))空气中的氧气也有一定的氧化性,防止制备的SO2气体中混有空气(O2),这时对说明Fe3+氧化SO2造成干扰,所以二氧化碳一定要纯净,
故答案为:防止制备的SO2气体中混有空气(O2)对说明Fe3+氧化SO2造成干扰;
(4)二氧化硫先和三价铁之间发生氧化还原反应,即 SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,然后生成的硫酸根离子再和钡离子之间反应,即Ba2++SO42-=BaSO4↓,
故答案为:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+、Ba2++SO42-=BaSO4↓.
本题解析:
本题难度:一般
2、填空题 空气中有大量的N2和O2,植物生长过程却要追加大量的氮肥,雷雨天,在雨水里能检测到一定量的硝态氮肥,所以有“雷 雨肥庄稼”之说。试回答:
(1)雷雨天在雨水里含有硝态氮肥的变化过程,用化学方程式表示是______________________。
(2)使空气中的氮气转化为硝态氮肥的过程称为___________。
(3)正常的雨水溶有CO2,pH=____;但有了上述(1)的变化,再加上SO2的溶解,pH降低,形成酸雨,造成对环境的污染。其主要危害有_______________。
(4)试写出SO2溶于水的化学方程式__________________。
参考答案:(1)N2+O2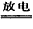 2NO;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO
2NO;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO
(2)氮的固定
(3)5.6;破坏农作物、森林、草原,使土壤、湖泊酸化,还会腐蚀建筑物、桥梁、工业设备、运输工具及通信电缆等
(4)SO2+H2O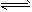 H2SO3
H2SO3
本题解析:
本题难度:一般
3、选择题 关于SO2和Cl2的叙述错误的是( )
A.都是大气污染物
B.密度都比空气的大
C.水溶液都呈酸性
D.都具有漂白性,能使有色物质永久性褪色
参考答案:A.氯气和二氧化硫都是有毒气体,都是大气污染物,所以不能直接排空,应该用碱液吸收,故A正确;
B.二氧化硫和氯气的摩尔质量大于空气的平均摩尔质量29,故密度大于空气,故B正确
C.二氧化硫和氯气,1体积水溶解2体积氯气,1体积水溶解40体积二氧化硫,氯气在水中的溶液呈酸性,二氧化硫溶于水生成亚硫酸溶液具有酸性,故C正确;
D.二氧化硫的漂白性是利用二氧化硫和有色物质反应生成不稳定的无色物质,加热恢复颜色,氯气的漂白原理是:氯气和水反应生成次氯酸,次氯酸具有漂白性,是利用次氯酸的强氧化性进行漂白,所以二者漂白原理不同,故D错误;
故选D.
本题解析:
本题难度:简单
4、选择题 除去SO2中混有的SO3气体,不能选用的试剂是( )
A.98.3% H2SO4
B.BaCl2溶液
C.饱和NaHSO3溶液
D.饱和NaHCO3溶液
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列实验操作正确且能达到预期目的是( )
| 实验目的 | 操?作
1
比较水和乙醇中羟基氢的活泼性强弱
用金属钠分别与水和乙醇反应
2
欲证明CH2=CHCHO中含有碳碳双键
滴入KMnO4酸性溶液,看紫红色是否褪去
3
欲除去苯中混有的苯酚
向混合液中加入浓溴水,充分反应后,过滤
4
证明SO2具有漂白性
将SO2通入酸性KMnO4溶液中
5
比较确定铜和镁的金属活动性强弱
用石墨作电极电解Mg(NO3)2、Cu(?NO3)2?的混合液
6
确定碳和硅两元素非金属性强弱
测同温同浓度Na2CO3和Na2SiO3水溶液的pH
|
A.①⑤⑥
B.①②⑥
C.①③④
D.②④⑥
参考答案:A
本题解析:
本题难度:简单