微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列试剂中能用来区分Fe2+和Fe3+的是( )
A.KSCN
B.FeCl3
C.H2SO4
D.NH4Cl
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列叙述不正确的是( ? )
A.钠燃烧时发出黄色火焰
B.在常温下,铝不能与氧气反应
C.常温下可以用铁罐装运浓硫酸
D.为了检验某FeCl2溶液是否变质,可向溶液中加入KSCN溶液
参考答案:B
本题解析:
本题难度:简单
3、实验题 有一瓶澄清的溶液,其中可能含有NH4+、K+、Ba2+、Al3+、Fe3+、I-、NO3-、CO32-、SO42-、AlO2-。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性;
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色;
③另取溶液适量,逐滴加入NaOH溶液:
a.溶液从酸性变为中性;b.溶液逐渐产生沉淀;c.沉淀完全溶解;d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝;
④取适量③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除___________的存在。
(2)由②可以证明___________的存在;同时排除____________的存在;理由是____________________
(3)由③可以证明___________的存在;写出c、d所涉及的化学方程式,是离子反应的用离子方程式表示:
c________________; d__________________
(4)由④可以排除____的存在,同时证明____的存在。
参考答案:(1)CO32-、AlO2-
(2)I-;Fe3+、NO3-;CCl4层呈现出碘的颜色,Fe3+、NO3-在该环境中与I-不能共存
(3)Al3+、NH4+;Al(OH)3+OH-=AlO2-+2H2O;NH3·H2O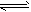 NH3↑+H2O
NH3↑+H2O
(4)SO42-;Ba2+
本题解析:
本题难度:一般
4、简答题 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,为了检验SO2和C2H4的性质,有人设计下列实验方案.
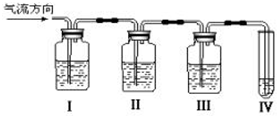
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是I______;Ⅱ______;Ⅲ______;Ⅳ______(将下列有关试剂的序号填入空格内);
A.品红溶液?B.NaOH溶液
C.浓H2SO4? D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是______;
(3)使用装置Ⅱ的目的是______;
(4)确定含有乙烯的现象是______.
(5)如果Ⅳ盛放的溶液为溴水,那么发生的化学方程式为______,反应类型为______.
参考答案:(1)乙烯不与NaOH溶液反应,但二氧化硫能与碱反应(SO2+2NaOH Na2SO3+H2O),二氧化硫是否存在可用品红溶液检验.乙烯的检验应放在排除SO2的干扰后进行,选通过品红溶液褪色检验SO2的存在;再通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净.最后用高锰酸钾酸性溶液褪色实验检验乙烯故答案为:A;B;A;D;
(2)二氧化硫是否存在可用品红溶液检验,故答案为:装置Ⅰ中品红溶液褪色;
(3)乙烯和二氧化硫都能使溴水或高锰酸钾酸性溶液褪色,检验乙烯时应先除去二氧化硫,故答案为:除去二氧化硫气体,以免干扰乙烯的实验;
(4)通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色实验检验乙烯,装置Ⅳ中的酸性高锰酸钾溶液褪色,说明含有乙烯,
故答案为:装置Ⅲ中的品红溶液不褪色,装置Ⅳ中的酸性高锰酸钾溶液褪色;
检查二氧化硫是否除尽;
(5)乙烯中含有C=C键,能与溴水发生加成反应生成二溴乙烷,反应的方程式为CH2=CH2+Br2→CH2Br-CH2Br,故答案为:CH2=CH2+Br2→CH2Br-CH2Br;加成.
本题解析:
本题难度:一般
5、填空题 某无色混合气体可能由NO、O2、NH3、CO2、HCl中的两种或几种组成。室温下50 mL的混合气体通过足量的浓硫酸,体积减少至40 mL,再通过足量的NaOH溶液,体积减少到20 mL,余下的气体接触空气后立即变色。则原混合气体中一定含有__________气体,其同温、同压下的体积比为____________ 。此混合气体中一定不含有___________气体,理由是_____________________。
参考答案:NH3、CO2、NO;1:2:2;HCl、O2;NH3会与HCl反应生成白色固体NH4Cl,有NH3就一定不含HCl,NO遇空气会变色,而混合气体无色,所以有NO就一定无O2
本题解析:
本题难度:一般