微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (8分)请用相关知识回答下列问题:
(1)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,实验过程测得的CO2气体体积随时间变化如右图所示。
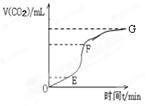
①________段化学反应速率最快,_______段收集的二氧化碳气体最多。
②除加入蒸馏水外,当加入下列物质中的?(填序号)时,则能够减缓上述反应的速率。
A.醋酸钠溶液? B.碳酸钙粉末? C.稀硫酸? D.浓盐酸
(2)原电池是一种能量装置。
①下列在理论上可用来设计原电池的反应是?(填序号)。
A.NaOH +HCl==NaCl+H2O ?B.2FeCl3+Cu=2FeCl2+CuCl2
C.CuSO4 +2NaOH== Cu(OH)2+NaSO4?D.C2H6O +3O2==3H2O+2CO2
②实验室中用锌片与硫酸反应制取氢气时,向反应溶液中滴加几滴CuSO4溶液,可以发现产生氢气速率明显加快,其原因是?。
参考答案:(1)①EF、EF;②AC;
(2)①BD;②锌与硫酸铜发生置换反应形成锌铜原电池,能加快反应速率。
本题解析:(1)有图像可知:在EF段单位时间内产生的CO2气体最多。因此化学反应速率最快。在EF段收集的二氧化碳气体的物质的量也最多。[②A.加入醋酸钠溶液,发生反应强酸HCl变为弱酸CH3COOH,c(H+)减小,反应速率减慢。正确。B.碳酸钙粉末,由于固体的接触面积增大,所以反应速率加快。错误。C.稀硫酸,发生反应产生难溶性的硫酸钙,附着在碳酸钙的表面,使物质接触面积减小,反应速率减慢。正确。D.浓盐酸c(H+)增大,反应速率加快。错误。(2)①原电池是摆化学能转化为电能的装置。因此若能设计为原电池,该反应应该是氧化还原反应。只有BD符合题意。②实验室中用锌片与硫酸反应制取氢气时,向反应溶液中滴加几滴CuSO4溶液,首先发生反应:Zn+ CuSO4= Cu+ZnSO4。产生的Cu附着在Zn上,Zn、Cu及硫酸就构成邻位原电池。由于发生原电池反应,所以反应速率大大加快。
本题难度:一般
2、填空题 燃料电池是目前正在探索的一种新型电池。它主要是利用燃料在燃烧过程中把化学能直接转化为电能,目前已经使用的氢氧燃料电池的基本反应是
x极:O2(气)+2H2O(液)+4e-=4OH-
y极:H2(气)+2OH--2e-=2H2O(液)
回答下列问题:
(1)x是________极,发生________反应。(填“氧化”或“还原”,下同)
(2)y是________极,发生________反应。
总反应方程式为______________________。
(3)若反应后得到5.4 g液态水,此时氢氧燃料电池转移的电子数为________。
参考答案:(1)正 还原 (2)负 氧化 2H2+O2=2H2O (3)0.6 NA
本题解析:(1)x极:O2得电子发生还原反应,所以为正极。(2)y极:H2失电子发生氧化反应,所以为负极。x极,y极得失电子应相同,故x极电极方程式与y极电极方程式乘以2相加得总反应方程式为2H2+O2=2H2O。
(3)4 mol e-~2H2O
4 mol? 2×18 g
n(e-)? 5.4 g
n(e-)=0.6 mol。
本题难度:一般
3、选择题 把a、b、c、d四块金属浸泡在稀硫酸中,用导线两两相连,可组成各种原电池,若a、b相连时,a为负极;c、d相连时,d上有气泡冒出;a、c相连时,c为正极;b、d相连时,d被腐蚀.则这四种金属的活动顺序由大到小为( )
A.a>b>c>d
B.a>c>d>b
C.c>a>b>d
D.b>d>c>a
参考答案:在原电池中,作负极的金属活动性较强,作正极的金属活动性较弱,作负极的金属被腐蚀,作正极的金属被保护,正极上氢离子得电子生成氢气,
若a、b相连时,a为负极,则金属活动性a>b;
c、d相连时,d上有气泡冒出,则d为正极,c为负极,金属活动性顺序c>d;
a、c相连时,c为正极,金属活动性顺序a>c;
b、d相连时,d被腐蚀,则d作负极,b作正极,金属活动性顺序d>b,
通过以上分析知,金属活动性顺序是a>c>d>b,
故选B.
本题解析:
本题难度:简单
4、选择题 下列各表述与示意图一致的是
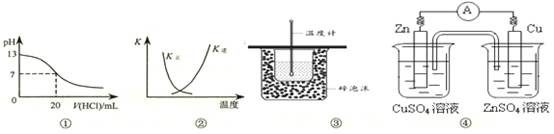
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③装置用于测定中和热
D.图④装置可以构成锌、铜、硫酸铜溶液原电池
参考答案:B
本题解析:A、0.1mol?L-1NaOH溶液的pH为13,用0.1mol?L-1盐酸滴定恰好中和时pH为7,因浓度相同,则体积相同,但酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故A错;B、因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K逆减小,而K正增大,且正逆反应的平衡常数互为倒数关系,故B正确;C、根据量热计的结构可知实验装置缺少环形玻璃搅拌棒,故C错;D、图④装置不能构成锌、铜、硫酸铜溶液原电池,应将硫酸铜和硫酸锌位置互换,D错。
本题难度:一般
5、选择题 铜片和锌片用导线连接后插入稀硫酸中,锌片为
[? ]
A.阴极
B.正极
C.阳极
D.负极
参考答案:D
本题解析:
本题难度:简单