|
高考化学知识点总结《电解质溶液中离子浓度大小的比较》考点巩固(2017年最新版)(十)
2017-09-25 16:17:27
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,用0.1000mol/L?HCl溶液滴定?20.00mL?0.1000mol/L?NH3?H2O溶液滴定曲线如图.下列说法正确的是( )
A.点①溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.点②溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.点③溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定过程中可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
| 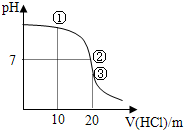
参考答案:A、由图象可知,点①反应后溶液是NH4C1与NH3?H2O物质的量之比为1:1的混合物,溶液呈碱性,说明NH3?H2O电离程度大于NH4C1的水解程度,故c(NH4+)>c (C1-)>c(OH-)>c(H+),故A错误;
B、由图象可知,点②pH=7,即c(H+)=c(OH-),由电荷守恒可知:c(C1-)+c(OH-)=c(NH4+)+c(H+),故c(NH4+)=c(C1-)>c(OH-)=c(H+),故B错误;
C、由图象可知,点③体积相同,则恰好完全反应生成NH4C1,NH4C1水解溶液呈酸性,则c(C1-)>c(NH4+)>c(H+)>c(OH-),故C错误;
D、当NH3?H2O较多,滴入的?HCl较少时,生成NH4C1少量,溶液中NH3?H2O浓度远大于NH4C1浓度,可能出现c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+),故D正确;
故选D.
本题解析:
本题难度:简单
2、填空题 按要求回答下列问题
(1)KHSO4溶液显________性(填“酸”?“碱”?或“中性”),其原因是(用电离方程式表示)_________________;
(2)?KHCO3溶液显________性(填“酸”?“碱”?或“中性”),其原因是(用离子方程式表示)____________________;?
(3)?将上述两溶液混合,离子反应方程式为___________________。
(4)在Na2CO3溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是________________,其原因是(以离子方程式和简要文字说明)?____________________________________________。
参考答案:(1)酸;KHSO4=K++H++SO42-
(2)碱;HCO3- + H2O  H2CO3 + OH- H2CO3 + OH-
(3)HCO3- +H+ =CO2↑ +H2O
 (4)溶液褪色或变浅;Ba2+ + CO32- =BaCO3↓ 生 (4)溶液褪色或变浅;Ba2+ + CO32- =BaCO3↓ 生 成 成 难溶BaCO3,使溶液水解碱性减弱 难溶BaCO3,使溶液水解碱性减弱
本题解析:
本题难度:一般
3、选择题 常温常压下,将a mol CO2气体通入1L b mol/L的NaOH 溶液中,下列对所得溶液的描述不正确的是
[? ]
A.当a=时,所得溶液中存在:c(Na+)>c(CO32-)> c(OH-)>c(HCO3-)>c(H+)
B.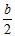 <a<b时,所得溶液中存在:c(Na+)>c(CO32-)+ c(HCO3-) +c(H2CO3) <a<b时,所得溶液中存在:c(Na+)>c(CO32-)+ c(HCO3-) +c(H2CO3)
C.当a=b时,所得溶液中存在:c(OH-)+c(CO32-)= c(H+) +c(H2CO3)
D.当a=b时,所得溶液中存在:c(Na+)>c(CO32-)> c(HCO3-)>c(OH-)>c(H+)
参考答案:D
本题解析:
本题难度:一般
4、选择题 常温下,将甲酸和氢氧化钠溶液混合,所得溶液?pH=7,则此溶液中( )
A.[HCOO-]>[Na+]
B.[HCOO-]<[Na+]
C.[HCOO-]=[Na+]
D.无法确定[HCOO-]与[Na+]的关系
参考答案:C
本题解析:
本题难度:简单
5、填空题 已知硫酸在水中的电离方程式是:H2SO4═?H+?+?HSO4-,?HSO4-? H++SO42-,回答下列问题: H++SO42-,回答下列问题:
(1)Na2SO4溶液显_______(填“酸性”,“中性”或“碱性”)。理由是__________(用离子方程式表示)?。
(2)在0.1?mol/L的Na2SO4溶液中,下列微粒浓度关系正确的有________。
A.c(SO42-)+c(HSO4-)+c(H2SO4)=0.1?mol/L?
B.c(OH-)=c(H+)+c(HSO4-)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(3)如果25?℃时,0.1?mol/L的NaHSO4溶液中c(SO42-)=0.029?mol/L,则0.1?mol/LH2SO4溶液中c(SO42-)_____0.029?mol/L(填“<”,“>”或“=”),理由是_________________。
(4)0.1?mol/LNaHSO4溶液中各种离子浓度由大到小的顺序是:________________。
(5)如果25?℃时,0.10?mol/LH2SO4溶液的pH=-lg?0.11,?则25?℃时,0.10?mol/L的H2SO4溶液中c(SO42-)=____________。
参考答案:(1)碱性;SO42-+H2O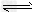 HSO4-+OH- HSO4-+OH-
(2)BCD
(3)<;H2SO4第一步电离产生的H+,抑制了HSO4-
(4)c(Na+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-)
(5)0.010 mol·L-1
本题解析:
本题难度:一般
| 